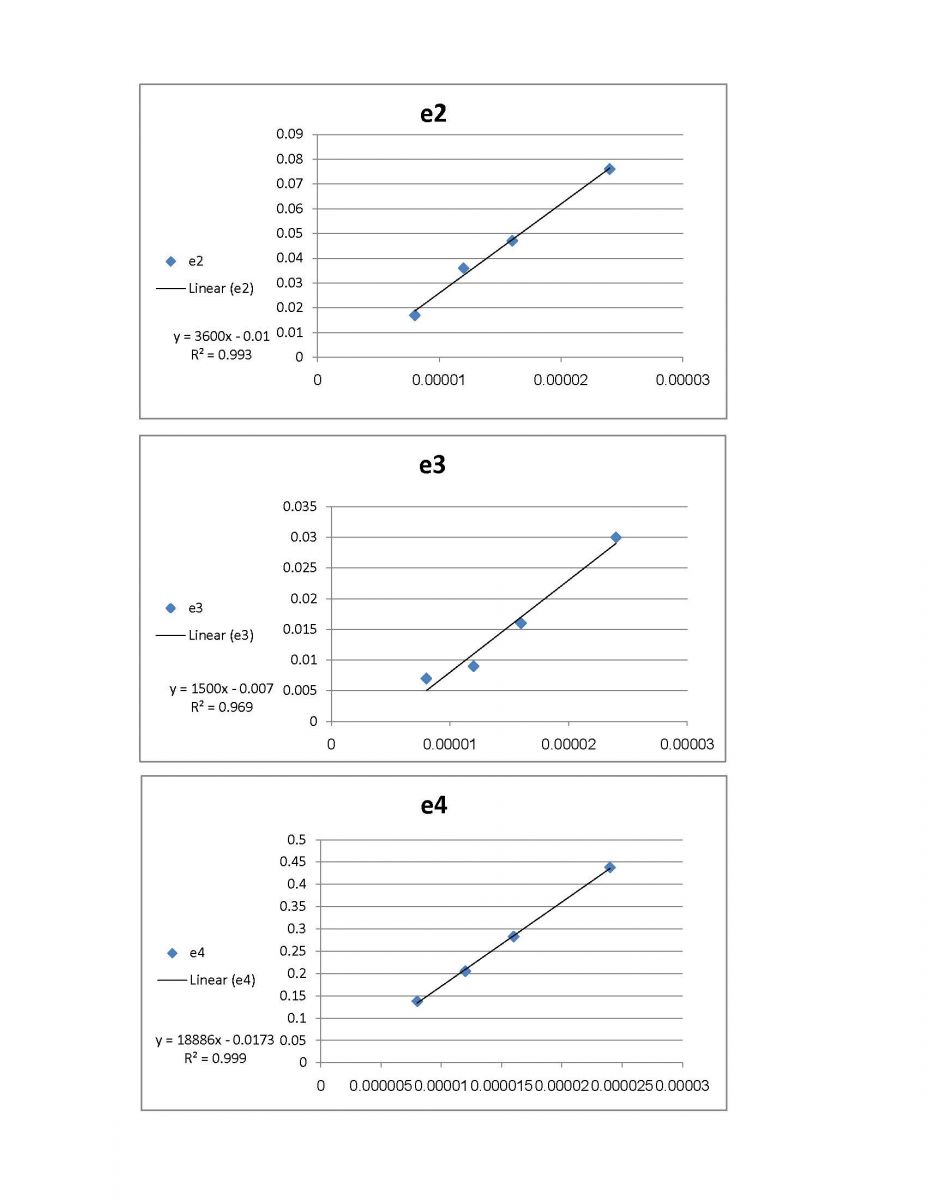
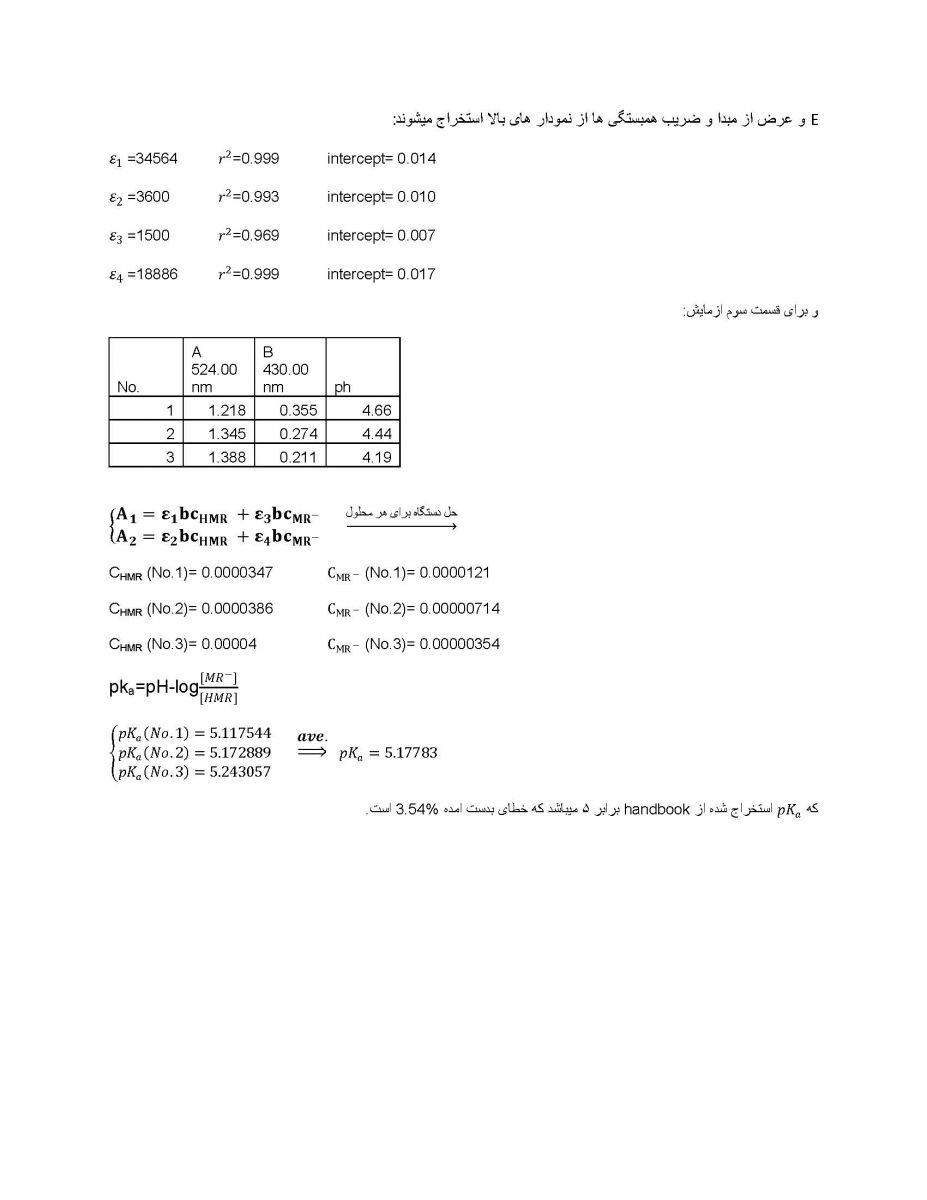
|
نام عنصر
|
نشانه اتمی
|
عدد اتمی
|
چگالی
g/cm3
|
نقطه ذوب
oc
|
جرم اتمی
|
شعاع اتمی
pm
|
شعاع یونی
pm
|
رنگ شعله
|
|
بریلیم
|
Be
|
4
|
1.82
|
1278
|
9.01
|
112
|
0.34
|
-
|
|
منیزیم
|
Mg
|
12
|
1.74
|
651
|
14.31
|
160
|
0.78
|
سفید
|
|
کلسیم
|
Ca
|
20
|
1.55
|
843
|
40.08
|
197
|
1.06
|
سرخ مایل یه نارنجی
|
|
استرانسیم
|
Sr
|
38
|
2.6
|
769
|
87.62
|
215
|
1.27
|
سرخ درخشان
|
|
باریم
|
Ba
|
56
|
3.5
|
725
|
137.33
|
222
|
1.43
|
زرد مایل به سبز
|
|
رادیم
|
Ra
|
88
|
700
|
1.57
|
منیزیم و ترکیبات آن مدت زمان مدیدی است که شناخته شده هستند. منیزیم هشتمین عنصر از نظر فراوانی در پوسته زمین به حساب می آید. این عنصر در نهشته های عظیم در کانیهای مگنزیت ، دولومیت و دیگر کانیها یافت می شود.
این عنصر از الکترولیز کلرید منیزیم ناشی از آبهای نمک دار، چاهها و آب دریاها حاصل می شود.
منیزیم عنصری سبک به رنگ سفید نقره ای است این عنصر به راحتی در درجه حرارت بالا می سوزد و شعله سفید رنگ و تابناکی در موقع سوختن نمایان می کند.
موارد استفاده این عنصر شامل مواد محترقه و منفجره شامل بمبهای آتش زامی باشد. حدود یک سوم ترکیبات آلومینیومی و آلیاژهای ضروری برای هواپیماها و موشکها از این عنصر استفاده می شود. این عنصر دارای خاصیت جوش خوردگی بهتر از آلومینیوم می باشد که برای عناصر آلیاژی مورد استفاده قرارمی گیرد. همچنین برای تولید گرافیتها ی حلقه ای چدنی کاربرد دارد.
همچنین این عنصر یک عامل کاهنده در تولید اورانیوم خالص و نمکهای فلزی است. هیدروکسید، کلرید ، سولفات و سیترات منیزیم در دندانپزشکی استفاده می شود. به علت اشتعال پذیری بالای این عنصر برای سوخت کوره های کارخانه ها استفاده می شود.
ترکیبات آلی منیزیم نقش حیاتی در زندگی گیاهی و جانوری دارند. کلرفیل گیاهان دارای منیزیم است.
به علت اشتعال پذیری بالای منیزیم موقع استفاده از این عنصر باید دقت لازم را به عمل بیاوریم. در موقع سوختن منیزیم نباید از آب استفاده کرد.
اثرات منیزیم بر سلامتی انسان
پودر منیزیم برای انسان خطرناک نمیباشد و خواص سمی آن پایین میباشد. با تنفس منیزیم ممکن است ذرات حاصل از منیزیم باعث آسیب به مخاط دهان و قسمتهای فوقانی دستگاه تنفس میشود. منیزیم باعث آسیبهای شدید در چشم میشود. شعله حاصل از منیزیم تحت نام Welder's flash نامیده میشود شعله سفید رنگ شدیدی است که مشاهده آن بدون استفاده از عینک باعث آسیب شدید چشها میشود. دستگاه گوارش: بلع مقدار قابل توجهی از پودر منیزیم باعث مسمومیت شدید میگردد.
تاکنون طعم منیزیم امتحان نشده است، اما به نظر میرسد که سرطانزا نباشد و به جنین آسیب نرساند. پرتودهی بخار اکسید منیزیم باعث سوختگی میشود. جوشکاری و فلزات مذاب سبب بروز تب بخار فلز شده و علائمی مانند، تب و لرز، استفراغ، تهوع و دردهای عضلانی را به همراه دارد. این علائم بعد از 4 تا 12 ساعت پس از پرتودهی منیزیم بروز میکند و تا 48 ساعت طول میکشد. بخار اکسید منیزیم از سوختن منیزیم بدست می آید.
خطرات فیزیکی: اگر منیزیم به شکل پودر یا ذره در محیط وجود داشته باشد ممکن است با هوا وارد واکنش شود و انفجار اتفاق افتد. این انفجار تحت نام انفجار غبار یا Dust explosion شناخته شده است. در شرایط خشک ، جابجایی ها، جریان هوا و ریختن منیزیم میتواند خطرناک باشد.
خطر شیمیایی:منیزیم در تماس با هوا یا محیط مرطوب خودبخود آتش میگیرد و بخارهای سمی و آزاردهنده تولید میکند. در این حالت منیزیم با اکسیدکننده های قوی به شدت واکنش میدهد. همچنین منیزیم با بسیاری مواد به شدت وارد واکنش میشود و خطر انفجار و آتش سوزی را به همراه دارد. منیزیم با انواع اسیدها و آب واکنش داده و گاز قابل اشتعال هیدروژن را تشکیل میدهد و سبب خطر آتش سوزی و انفجار میشود.
کمکهای اولیه: در صورت تنفس منیزیم، هوای محیط را باید تغییر داده و امکان ورود هوا تازه را باید فراهم کرد. در صورتی که منیزیم وارد چشم شود، چشمها را باید با آب شستشو داده و سپس به پزشک مراجعه کرد. در صورتیکه پوست با منیزیم تماس پیدا کند محل برخورد با منیزیم را باید با آب و صابون شستشو داد و ذرات منیزیم را از آن خارج کرد. در صورتی که مقدار قابل توجهی از منیزیم بلع شود، استفراغ نموده و سپس به پزشک مراجعه کنید.
پزشکان باید توجه کنند که برای منیزیم هیچگونه روش درمانی یا پادزهری وجود ندارد. درمان باید از روی علائمی که بیمار از خود نشان میدهد، صورت گیرد.
اثرات منیزیم بر محیط زیست
از تاثیر بخار اکسید منیزیم بر محیط زیست اطلاعات اندکی در دست است. اگر سایر پستانداران بخار اکسید منیزیم را تنفس کنند، علائم مشابه علائم انسان، از خود نشان میدهند.
از لحاظ زیست محیطی، طیف بخار اکسید منیزیم بین 0 تا 3 میباشد اما مقدار پذیرفته شده آن 0.8 است. عدد 3 بیانگر خطرات بسیار بالا برای محیط زیست است و عدد 0 نماینده مقدار ناچیز منیزیم و پایین بودن میزان خطر است. عواملی که برای این تقسیم بندی در نظر گرفته شده است شامل سمی بودن ماده و یا نبود مسمومیت، اندازه گیری توانایی میزان فعالیت ماده در محیط زیست و تجمع منیزیم در ارگانیسمهای موجود زنده است.
به نظر میرسد که پودر منیزیم برای محیط زیست خطرناک نمیباشد. مقدار منیزیمی که محیطهای آبی میتوانند تحمل کنند، 1000 ppm میباشد.
خواص فیزیکی و شیمیایی عنصر منیزیم :
عدد اتمی: 12
جرم اتمی: 24.3050
نقطه ذوب C°650
نقطه جوشC°1090
شعاع اتمیÅ 1.72
رنگ: سفید نقره ای
حالت استاندارد: جامد دیامغناطیس
نام گروه: 2-قلیایی خاکی
انرژی یونیزاسیون Kj/mol 737.7
شکل الکترونی: 11s2 2s2p6 3s2
شعاع یونیÅ: 0.72
الکترونگاتیوی:1.31
حالت اکسیداسیون:2
دانسیته:
گرمای فروپاشی Kj/mol 8.954
گرمای تبخیر Kj/mol:127.4 l
مقاومت الکتریکی Ohm m 4.48
گرمای ویژه: J/g Ko 1.02
دوره تناوبی: 3
اکسید منیزیم MgO
هیدرید منیزیم MgH2
کلرید منیزیم MgCl2
منابع : آب دریا و کانی مگنزیت
کاربرد : در ساخت آلیاژهای مورد نیاز هواپیما ، موشک ، دوچرخه های مسابقه و لوازمی که نیاز به فلز سبک دارند به کار می رود همچنین در کوره های آجر پزی ، لامپ فلاش دوربین و فیلتر به کار می رود .
کلسیم عنصری فلزی است که حدود 3 درصد از پوسته زمین را تشکیل می دهد. این عنصر جز اصلی تشکیل دهنده دندانها، استخوانها و پوسته صدفها می باشد. این عنصر به حالت آزاد در طبیعت یافت نمی شود و به صورت ترکیب است و به صورت فراوان در سنگ آهک ، ژیپس و فلوریت یافت میشود. آپاتیت فلوئوروفسفات یا کلروفسفات از کلسیم ساخته شده است.
این فلز دارای رنگ نقره ای با سختی بالا است. از نظر شیمیایی یک فلز قلیایی در پوسته زمین است که به صورت یک لایه نازک سفیدرنگی از نیتریت درهوا وجود دارد. این عنصر با آب واکنش می دهد و با شعله زرد قرمز می سوزد.
این فلز یک عامل کاهنده برای دیگر فلزاتی مثل توریم، اورانیوم، زیرکونیوم است و ترکیبات کلسیم دار شامل دی اکسید کلسیم ، دی سولفید یا دی کربنی برای آلیاژهای آهندار و بدون آهن استفاده می شود. همچنین این عنصر آلیاژی برای ترکیبات آلومینیوم برلیم و مس و سرب ومنیزیم جهت استفاده گاز باقیمانده در بمب خلا استفاده می شود.
این عنصر به صورت آزاد و به صورت ترکیب در طبیعت یافت می شود. آهک خام با گرما تبدیل به سنگ آهک و سنگ آهک با اضافه شدن آب تبدیل به آهک مرده می شود. که آهک مرده کاربردهای زیادی در تصفیه شیمیایی دارد. وقتی آهک با ماسه ترکیب می شود باعث سخت شدن ملات و گچ می گردد و که این سخت شدن توسط جذب دی اکسید کربن هوا صورت می گیرد. کلسیم عنصر مهمی در سنگ آهک است که در تهیه سیمان پورتلند مورد استفاده قرار می گیرد.
از حل شدن آب در کربنات دی اکسید کربن تولید می شود که این فرایند در غارها باعث تشکیل فرمهای استالاکتیت و استالاگمیت می شود. از دیگر ترکیبات مهم کلسیم می توان از کربید، کلرید، سیانامید، هیپوکلریت، نیترات و سولفید می باشد.
برخی اوقات کلسیم را به عنوان سنگ آهک به حساب می آورند. کلسیم در فرآورده های لبنی مورد استفاده قرار میگیرد و همچنین در سبزیجات، آجیل و حبوبات نیز پتاسیم وجود دارد. کلسیم یکی از عمده ترین نگهدارنده های اسکلت و دندانهای انسان است. همچنین کلسیم به سیستم عصبی و عضلات کمک میکند. مصرف بیش از 2.5 گرم کلسیم در روز، بدون تجویز پزشک باعث سنگ کلیه و تصلب کلیه ها و رگهای خونی میشود.
کمبود کلسیم یکی از عوامل بیماری پوکی استخوان است. در بیماری پوکی استخوان، استخوانها به شدت دارای منفذ میشوند و ممکن است عاملی برای شکستگی استخوان شده و درمان را کندتر میکند. پوکی استخوان اغلب در زنان دیده میشود و پس از یائسگی به آن دچار میشوند. بیماری پوکی استخوان در نهایت باعث خمیدگی ستون فقرات شده و سبب از بین رفتن مهره ها میگردد.
برخلاف آنچه که مردم تصور میکنند، فعالیت زیستی شدیدی در استخوانهای بدن انسان انجام میشود. در استخوانهای بدن انسان مرتباً بافتهای قدیمی از بین میروند و بافتهای جدید جانشین آنها میشوند. طی دوران کودکی و نوجوانی سرعت تولید بافتهای جدید به مراتب بیشتر از بافتهای قدیمی است. اما در سن 30 تا 35 سالگی فرآیند برعکس میشود و بر تعداد بافتهای قدیمی افزوده شده و بافتهای تشکیل د
به نام خالق زیبایی ها
گزارش کار ازمایشگاه شیمی عمومی
فائزه پونکی
کاتیون های گروه 1:
جيوه ( Hg )
جيوه عنصري فلزي به رنگ نقره اي با ساختار رومبوئدرال که در دماي معمولي مايع است . جيوه به صورت آزاد در طبيعت نادر يافت مي شود و به صورت عمده در سنگ معدن سينابر در اسپانيا و ايتاليا وجود دارد . جيوه رسانايي ناچيزي از حرارت در مقايسه با فلزات ديگر دارد اما رساناي متوسطي از الکتريسيته است .
اين عنصر در گذشته در کشورهاي چين و هند شناخته شده بود و در1500 سال قبل از ميلاد در اهرام مصر نيز وجود داشته است. اين عنصر به حالت آزاد در طبيعت پيدا مي شود. مهمترين کاني اين عنصر سينابر است. حدود 50 درصد از توليدات اين عنصردر دنيا در کشورهاي ايتاليا و اسپانيا توليد مي شود. اين فلز از گرما دادن به سينابر در هوا توسط متراکم کردن بخار توليد مي شود.
جیوه فلزي سنگين، به رنگ سفيد نقره اي است. رساناي ضعيف گرما است. نمک هاي مهم جيوه عبارتند از : کلريد جيوه، فولمينات جيوه ، که کاربرد گسترده اي به عنوان چاشني در مواد منفجره دارد . از ديگر نمک هاي جيوه مي توان سولفيد جيوه را نام برد.
خواص
جيوه داراي خاصيت سمي است و به آساني توسط دستگاه تنفسي جذب مي شود. و به معده و روده آسيب مي رساند. وجود اين عنصر در هوا خطرناک به نظر مي رسد.
جيوه موجود در هوا اگر از يک حدي تجاوز کند خطرناک به نظر مي رسد. با افزايش درجه حرارت ، وجود جيوه در هوا خطرناکتر به نظر مي رسد. بنابراين در موقع استفاده با آن مخصوصاً با دست بايد دقت لازم را به عمل آورد. متيل جيوه يک نوع آلاينده خطرناک است که به طور گسترده در آب و بخار يافت مي شود.
کاربردها
از جيوه به طور گسترده در آزمايشگاه ها براي ساخت فشار سنج ها و پمپ هاي تخليه فشار و ديگر تجهيزات استفاده مي شود. از بخار جیوه براي ساخت لامپ ها و تابلوهاي تبليغاتي و غيره استفاده مي شود. و همين طور براي ساخت سوئيچ هاي جيوه اي و ديگر دستگاه هاي الکتروني استفاده مي شود. از ديگر کاربردهاي اين عنصر براي ساخت آفت کش ها و پيل هاي جيوه اي و دندانسازي و عامل ضد رسوب در رنگ ها و باتري ها است و همچنين به عنوان کاتاليزوراستفاده مي شود.
اثرات جيوه بر روي سلامتي
جيوه ترکيبي است که به طور طبيعي در محيط زيست وجود دارد. اين ماده به شکل فلزي و به صورت نمک هاي جيوه يا به صورت ترکيبات آلي جيوه يافت مي شود.
جيوه فلزي در بسياري از لوازم خانگي مانند فشارسنج، دماسنج، و لامپ فلوئورسنت به کار مي رود. جيوه در اين لوازم در فضايي محصور شده و باعث ايجاد عارضه اي نمي شود. اما وقتي دماسنج بشکند، مقدار زيادي از جيوه از راه تنفس و طي مدتي کوتاه ضمن تبخير وارد بدن مي شود. اين جيوه باعث اثرات مضري مانند آسيب اعصاب، مغز و کليه، سوزش ريه، سوزش چشم، تحريک پوست، اسهال و استفراغ مي شود.
جيوه به طور طبيعي در غذا وجود ندارد اما از طريق جانداران کوچکتري که انسان آنها را مي خورد، نظير ماهي ها، وارد زنجيره غذايي مي شود. معمولا غلظت جيوه موجود در ماهي ها بيشتر از غلظت جيوه موجود در آبي است که در آن زندگي مي کنند . محصولات لبني گاوها هم ممکن است داراي غلظت بالاي جيوه باشند. معمولا جيوه در مواد گياهي وجود ندارد اما وقتي در کشاورزي اسپري هاي حاوي جيوه مورد استفاده قرار گيرد، اين جيوه از طريق گياهان وارد بدن انسان مي شود.
جيوه بر روي انسان اثراتي دارد که مي توان آنها رابه صورت زير خلاصه کرد :
- اختلال سيستم عصبي- اختلال در عملکرد مغز- آسيب DNA و آسيب کروموزوم
- واکنش هاي آلرژيک شامل خارش پوست، خستگي و سردرد
- اثرات منفي بر روي باروري مانند آسيب اسپرم، اثرگذاري منفي بر روي زايمان و سقط جنين
اختلال در عملکرد مغز باعث کاهش قدرت يادگيري ، تغيير شخصيت، رعشه، تغيير قدرت ديد، کري، ناهماهنگي ماهيچه ها و از دست دادن حافظه مي شود. آسيب کروموزوم نیز باعث مونگوليسم مي شود.
اثرات زيست محيطي جيوه
جيوه در اثر شکسته شدن طبيعي کاني هاي موجود در سنگ و خاک و از طريق باد و آب وارد محيط زيست مي شود. انتشار جيوه حاصل از منابع طبيعي سال ها است که رخ مي دهد. هنوز هم غلظت جيوه موجود در اثر فعاليت هاي بشري، در محيط در حال افزايش است. قسمت عمده جيوه حاصل از فعاليت هاي بشري به واسطه احتراق سوخت هاي طبيعي، فعاليت هاي معدني، احتراق و ذوب زباله هاي جامد وارد هوا مي شود. بعضي از فعاليت هاي بشري مانند کودهاي کشاورزي و شيرابه هاي صنعتي باعث مي شوند که جيوه به طور مستقيم وارد خاک يا آب شود. کل جيوه اي که در محيط زيست پراکنده مي شود در نهايت در خاک يا آب هاي سطحي تجمع مي يابد.
جيوه موجود در خاک، در قارچ ها تجمع مي يابد. آب هاي سطحي اسيدي مقدار قابل توجهي جيوه دارند. وقتي pH آب بين 5 و 7 باشد، غلظت جيوه موجود در آب به علت حرکت و جابه جايي جيوه در زمين بالا مي رود. وقتي جيوه به آب هاي سطحي يا ميکرو ارگانيسم هاي خاک برسد، به متيل جيوه تبديل مي شود که جانداران به سرعت اين ماده را جذب مي کنند و اين ماده باعث آسيب سيستم عصبي مي شود. ماهي ها هر روز مقدار زيادي از متيل جيوه را از آب هاي سطحي جذب مي کنند. در نتيجه متيل جيوه در بدن آنها تجمع مي يابد و با توجه به اين که ماهي ها بخشي از زنجيره غذايي هستند، وارد زنجيره غذايي مي شود.
اثراتي که جيوه بر روي جانوران دارد عبارتند از :
آسيب کليه ، اختلال عملکرد معده ، آسيب روده ، ناباروري و تغيير DNA.
خواص فيزيکي و شيميايي
عدد اتمي : 80 جرم اتمي : 200.59 نقطه ذوب : 83/38 نقطه جوش : 73/356 شعاع اتمي : 1.76 ظرفيت : 2+ و 1+ رنگ : سفيد نقره اي حالت استاندارد : مايع
نام گروه : 12 انرژي يونيزاسيون : 1/1007
شعاع يوني : 1.02 الکترونگاتيوي : 2.00 حالت اکسيداسيون : 2 دانسيته : 1.3579 گرماي فروپاشي : 295 گرماي تبخير : 229/59 مقاومت الکتريکي: 000000961/0 اهم گرماي ويژه: 139/0 دوره تناوبي : 6 درجه اشتعال : در حالت مايع غير قابل اشتعال است اشکال ديگر : اکسيد جيوه HgO- دي کلريد جيوه - دي کلريد دي جيوه
سرب ( Pb )
سرب عنصری فلزی است که در جدول تناوبي با نشان Pb خلاصه ی نام لاتين plumbum و عدد اتمي 82 وجود دارد. عنصري سنگين ، سمي و چکش خوار و داراي رنگ خاکستري کدري مي باشد که با ساختار کوبيک متبلور مي شود. اين عنصر معمولاً در سنگ معدن گالن يافت مي شود . .هنگاميکه تازه تراشيده شده سفيد مايل به آبي است اما در معرض هوا به رنگ خاکستري تيره تبديل مي شود و از خاصيت هدايت الکتريکي پاييني برخوردار مي باشد . اين فلز حقيقي به شدت در برابر پوسيدگي مقاومت مي کند و به همين علت از آن براي نگهداري مايعات فرسايشگر (مثل اسيد سولفوريک) استفاده مي شود. با افزودن مقادير خيلي کمي آنتيموان يا فلزات ديگر به سرب مي توان آن را سخت نمود. از سرب در سازه هاي ساختماني ، خازنهاي اسيد سرب ، ساچمه و گلوله استفاده شده و نيز بخشي از آلياژهاي لحيم ، پيوتر و آلياژهاي گدازپذير است. سرب سنگين ترين عنصر پايدار است.
سرب عنصري فوق العاده سمي است که اثرات آن در طولاني مدت ظاهر مي شود . اثر سرب در سيستم عصبي موجب پايين آمدن بهره هوشي و ديگر اختلالات عصبي مي شود . علاوه بر سيستم عصبي ، سرب بر ديگر اعضاي بدن نيز تأثير منفي مي گذارد .
اين عنصر از مدت ها سال پيش شناخته شده و حداقل از 7000 سال پيش مورد استفاده بشر بوده است .در کتاب خروج (بخشي از انجيل) به اين عنصر اشاره شده است. کيمياگران مي پنداشتند سرب قديمي ترين فلز بوده و به سياره زحل مربوط مي شود. این عنصر به صورت آزاد در طبيعت يافت مي شود و به طور عمده در کاني گالن با ترکيب PbS طي فرايند تشويه حاصل مي شود. از ديگر کاني هایي که سرب در آن ها وجود دارد Anglesite , cerussite است. اين عنصر داراي جلاي فلزي است و همين طور داراي رسانايي پايين جريان برق است و چکش خوار و مفتول پذير است. اين فلز مقاومت بالايي در برابر خوردگي دارد.
سرب طبيعي ترکيبي از 4 ايزوتوپ پايدار است. درصد ايزوتوپ هاي مختلف سرب در طبيعت به ترتيب زير است : [ ] . ايزوتوپ هاي سرب داراي سه سري عناصر راديواکتيو طبيعي هستند. Pb206 براي سري اورانيم ، Pb207 براي سري اکتينيم ، Pb208 براي سري توريم . 27 ايزوتوپ ديگر که همه آنها نیز راديواکتيو هستند براي سرب شناخته شده است.
کاربردها
کاربردهاي اوليه سرب عبارت بودند از: سازه هاي ساختماني ، رنگدانههاي مورد استفاده در لعاب ، سراميک و لولههاي انتقال آب . کاخ ها و کليساهاي بزرگ اروپا که وسايل تزئيني ، سقف ها ، لولهها و پنجرههايشان داراي مقادير قابل توجهي سرب هستند. اين فلز ( در حالت عنصري ) پس از آهن ، آلومينيوم ، مس و روي بيشترين کاربرد را دارد.
سرب و دي اکسيد سرب به مقدار زياد براي ذخيره سازي باتري ها کاربرد دارد.
فلز سرب عامل موثري براي جذب صدا است. که به علت اين قابليت از آن براي پوشش تجهيزات اشعه ايکس و رآکتورهاي نوتروني براي جذب ارتعاش استفاده مي شود.
از اکسيد سرب هم براي توليد شيشه هاي کريستالي ظريف و ظروف بلور با خاصيت انعکاس نور بالا براي لنزهاي اکروماتيک استفاده مي شود. نيترات و استات سرب نمک هايی محلول هستند. نمک هاي سرب مثل ارسنات سرب براي حشره کش ها استفاده مي شود.
شناسایی و جداسازي
سرب محلي در طبيعت يافت مي شود اما کمياب است. امروزه معمولا سرب در کاني هايي همراه با روي ، نقره و (بيشتر) مس يافت مي شود و به همراه اين مواد جدا مي گردد. ماده معدني اصلي سرب گالن (PbS) است که حاوي 6/86% سرب مي باشد. سايرکاني هاي مختلف و معمول آن سروسيت ( PbCO3 ) و انگلسيت (PbSO4) مي باشند. اما بيش از نيمي از سربي که امروزه مورد استفاده قرار مي گيرد بازيافتي مي باشد.
سنگ معدن بوسيله مته يا انفجار جداشده سپس آن را خرد کرده و روي زمين قرار مي دهند. بعد از آن سنگ معدن تحت تاثير فرآيندي قرار مي گيرد که در قرن نوزدهم در Broken Hill استراليا بوجود آمد. يک فرآيند شناورسازي ، سرب و ديگر مواد معدني را از پس مانده هاي سنگ جدا مي کند تا با عبور سنگ معدن ، آب و مواد شيميايي خاص از تعدادي مخزن که درون آنها دوغاب هميشه مخلوط مي شود ، عصاره اي بوجود آيد . درون اين مخزن ها هوا جريان يافته و سولفيد سرب به حباب ها مي چسبد و به صورت کف بالا آمده که مي توان آن را جدا نمود. اين کف ( که تقريبا داراي 50% سرب است) خشک شده سپس قبل از پالايش به منظور توليد سرب 97% سينتر مي شوند. بعد ازآن سرب را طي مراحل مختلف سرد کرده تا ناخالصي هاي سبک تر بالا آمده و آنها را جدا مي کنند. سرب مذاب با گداختن بيشتر بوسيله عبور هوا از روي آن و تشکيل لايه اي از تفاله فلز که حاوي تمامي ناخالصي هاي باقي مانده مي باشد تصفيه شده و سرب خالص 9/99% بدست مي آيد.
اثرات سرب بر روي سلامتي
سرب يکي از چهار فلزي است که بيشترين عوارض را بر روي سلامتي انسان دارد. سرب از راه غذا (65%)، آب (20%) و هوا (15%) وارد بدن انسان مي شود. غذاهايي مانند ميوه، سبزيجات، گوشت، دانه ها، جانوران دريايي، نوشيدني ها و شراب حاوي مقدار زيادي سرب هستند. دود سيگار هم مقدار اندکي سرب دارد.
سرب با خوردگی لوله هاي انتقال آب، وارد آب آشاميدني مي شود. اگر آب اندکي اسيدي باشد، احتمال خوردگي بيشتر است. به همين علت است که در سيستم هاي تصفيه آب، بايد pH آب آشاميدني مناسب باشد.
تا جايي که ما مي دانيم سرب در بدن انسان عملکردي ندارد و تنها پس از جذب از راه غذا، هوا يا آب باعث آسيب بدن مي شود.
سرب آثار ناخواسته اي را به دنبال دارد که عبارتند از:
- اختلال بيوسنتز هموگلوبين و کم خوني
- افزايش فشارخون- آسيب کليه- سقط جنين و نارسي نوزاد- اختلال سيستم عصبي
- آسيب مغز- ناباروري مرد و آسيب اسپرم- کاهش قدرت يادگيري در بچه ها
- اختلالات رفتاري در بچه ها مانند پرخاشگري و بيش فعالي
سرب از راه جفت وارد بدن جنين مي شود. به همين علت، سرب باعث آسيب جدي سيستم عصبي و مغز جنين مي شود.
اثرات زيست محيطي
سرب به طور طبيعي در محيط زيست وجود دارد. اما در اکثر موارد سرب موجود در طبيعت حاصل فعاليت هاي بشري است. به علت کاربرد سرب در بنزين، چرخه سرب غير طبيعي شده است. در موتور ماشين، سرب مي سوزد بنابراين نمک هاي سرب (کلرين، برمين، اکسيدها) تشکيل مي شوند.
نمک هاي سرب از راه اگزوز ماشين ها وارد محيط زيست مي شود. ذرات بزرگتر بلافاصله روي زمين ته نشين مي شوند و خاک ها و آب هاي سطحي را آلوده مي کنند و ذرات کوچکتر از طريق هوا مسافت هاي طولاني را طي کرده و در جو باقي مي مانند. بخشي از اين سرب، به هنگام باران به زمين برمي گردد. چرخه سرب در اثر فعاليت هاي بشري نسبت به چرخه طبيعي گسترده تر شده است. همين امر باعث آلودگي سرب در سرتاسر دنيا شده است.
فقط بنزين سرب دار نيست که باعث افزايش غلظت سرب در محيط زيست مي شود. ديگر فعاليت هاي بشري مانند احتراق سوخت، فرآيندهاي صنعتي و سوزاندن زباله جامد هم باعث آلودگي با سرب محيط زيست مي شوند.
سرب به واسطه خوردگي لوله هاي سربي در سيستم انتقال آب وارد آب و خاک مي شود. سرب شکسته نمي شود و تنها به اشکال ديگر تبديل مي شود.
سرب در بدن جانداران آبزي و جانداران خاک تجمع مي يابد. اين موجودات در اثر سم سرب دچار عوارضي مي شوند. غلظت بسيار اندک سرب هم روي حلزون هاي دريايي اثرات منفي ميگذارد. سرب عملکرد فيتوپلانکتون ها را مختل مي کند. فيتوپلانکتون يکي از منابع مهم توليد اکسيژن در درياهاست و بسياري از جانوران بزرگتر آن را مي خورند. به همين علت است که آلودگي سرب تعادل جهاني را بر هم مي زند.
سرب، به ويژه در نزديکي بزرگراه ها و مزارع که غلظت آن بالاست، عملکرد خاک را بر هم مي زند. جانداران خاک هم از سم سرب آسيب مي بينند.
خواص فيزيکي و شيميايي
عدد اتمي : 82
جرم اتمي : 207.2 نقطه ذوب: 46/327 نقطه جوش : 1749 شعاع اتمي : 1.81 ظرفيت : 4+,2+ رنگ : سفيد متمايل به آبي حالت استاندارد : جامد نام گروه : 14 انرژي يونيزاسيون : 6/715 شعاع يوني : 1.19 الکترونگاتيوي: 33/2 &
سلام دوستان؛
درصورت تمايل مي توانيد ساير گزارشكارهايي رو كه نوشتم در وبلاگ زير (وبلاگ مهندسين پليمر، وروديهاي 89)
مشاهده و Download كنيد:
اميدوارم مفيد وموءثر باشد:
استاد اين مطلب رو به شما ايميل خواهم كرد.
دوستان عزیز
با عرض پوزش
دسترسی به ایمیل در حال حاضر غیر ممکن شده
لطفا در صورت عدم اپلود گزارشکارها در وبلاگ لطفا کپی گزارش خودرا در روز ازمایش خود به همراه داشته باشید.
با تشکر
شکیبازاده
توجه شما را به گزارشكار آزمايش جلسهء دوم (حجم مولي جزئي و ظاهري) + (تابعيت حلاليت از درجه حرارت) كه
در دو لينك زير آپلود كرده ام جلب مي كنم.
اميدوارم تحت تاثير قرار بگيريد:
استاد البته اين مطلب رو بصورت ايميل هم براتون فرستادم:
Better safe than sorry
سلامی دوباره به دانشجویان عزیز:
هنگامی که در حال ارسال گزارس کارهای خود هستتید متنتان را با اندازه ی 12 و به رنگ مشکی ارسال کنید
با تشکر
شکیبازاده
|
حجم سود مصرفی
|
وزن ارلن با محلول
|
دمای محلول
|
وزن خالی ارلن
|
|
|
10.4ml
|
69.82gr
|
60
|
59.39gr
|
ارلن1
|
|
9.7ml
|
63.99gr
|
55
|
54.65gr
|
ارلن2
|
|
10.1ml
|
77.10gr
|
50
|
67.46gr
|
ارلن3
|
|
9.6ml
|
64.94gr
|
45
|
55.53gr
|
ارلن4
|
|
8.9ml
|
77.82gr
|
40
|
68.03gr
|
ارلن5
|
|
8.5ml
|
67.22gr
|
35
|
57.86gr
|
ارلن6
|
|
اختلاف وزن ارلن های پروخالی
|
|
|
10.43gr
|
ارلن1
|
|
9.34gr
|
ارلن2
|
|
9.64gr
|
ارلن3
|
|
9.41gr
|
ارلن4
|
|
9.79gr
|
ارلن5
|
|
9.36gr
|
ارلن6
|
|
ارلن6
|
ارلن5
|
ارلن4
|
ارلن3
|
ارلن2
|
ارلن1
|
|
0.085mol/lit
|
0.089mol/lit
|
0.096mol/lit
|
0.101mol/lit
|
0.097mol/lit
|
0.104mol/lit
|
|
ارلن6
|
ارلن5
|
ارلن4
|
ارلن3
|
ارلن2
|
ارلن1
|
|
0.1037gr
|
0.10858gr
|
0.11712gr
|
0.12322gr
|
0.11834gr
|
0.12688gr
|
|
ارلن6
|
ارلن5
|
ارلن4
|
ارلن3
|
ارلن2
|
ارلن1
|
|
9.2563gr
|
9.68142gr
|
9.29288gr
|
9.51678gr
|
9.22166gr
|
10.30312gr
|
|
ارلن6
|
ارلن5
|
ارلن4
|
ارلن3
|
ارلن2
|
ارلن1
|
|
0.0918mol/gr
|
0.0919mol/gr
|
0.1033mol/gr
|
0.1061mol/gr
|
0.1052mol/gr
|
0.1009mol/gr
|
|
ارلن6
|
ارلن5
|
ارلن4
|
ارلن3
|
ارلن2
|
ارلن1
|
|
10.37gr/lit
|
10.858gr/lit
|
11.712gr/it
|
12.322gr/lit
|
11.834gr/lit
|
آزمایش شیمی و فیزیک
|
اسید استیک
|
آب
|
تولوئن
|
شماره محلول
|
|
cc3
|
cc13
|
cc13
|
1
|
|
Cc 6
|
cc10
|
cc13
|
2
|
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
شماره محلول
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
تولوئن
|
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
آب
|
|
19.3
|
22.1
|
23.8
|
23.5
|
22.9
|
20.5
|
17.3
|
13.5
|
9.8
|
اسید استیک
|
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
شماره محلول
|
|
29.88
|
24.31
|
20.25
|
17.58
|
14.99
|
13.03
|
11.02
|
8.66
|
5.24
|
درصد وزنی آب
|
|
2.89
|
5.26
|
7.52
|
10.17
|
13.01
|
16.94
|
22.30
|
ارسال توسط آخرین مطالب
|



 آمار
وب سایت:
آمار
وب سایت:

