دانشجو های عزیز:
سیمین بیات
امیر حسین حسین علی زاده
hossein i
900469434
سعیده علی پور
سمانه مویدی
مریم مشهدی
ارزو فتحی
زهرا کیانی
الناز انتظاری
سمن صبری
گزارش های شما به دستم رسید ولی به علت تکراری بودن در صفحه نمایش داده نمیشود.
نمودار سه جزيي
|
ش محلول
|
تولوءن
|
اب
|
اسيد استيك
|
|
1
|
13
|
13
|
3
|
|
2
|
13
|
10
|
6
|
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
اب
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
تولوين
|
|
18.2
|
21.8
|
24.2
|
24.4
|
23
|
19.9
|
18.3
|
13.9
|
9.5
|
اسيد
(بدست امده از تيتر)
|
|
حجم سود(بدست امده از تيتر)(cc)
|
نوع و شماره محلول
|
|
10.9
|
الي ش 1
|
|
35.6
|
ابي ش1
|
|
3.8
|
الي ش2
|
|
17.2
|
ابي ش2
|
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
حجم اب
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
جرم اب
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
0.5
|
0.44
|
0.38
|
0.33
|
0.27
|
0.22
|
0.16
|
0.11
|
0.05
|
مول اب
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
27.7
|
15.7
|
10.10
|
7.02
|
4.8
|
3.38
|
2.16
|
1.33
|
0.49
|
درصد مولي
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
31.03
|
24.54
|
20
|
17.14
|
14.92
|
13.33
|
10.6
|
ارسال توسط ارسال توسط رومینا
بسم الله الرحمن الرحیم
نام استاد : سرکار خانم رومینا شکیبا زاده نام دانشجویان : مهان خسروی 890180812 یاسمن یعسوبی 890181084
رشته تحصیلی: مهندسی پلیمر سال تحصیلی 90-91 نیمسال دوم
شماره ی گروه : 2 جذب سطحی Surface Adsorption of Acetic Acid ارسال توسط رومینا نام دانشکده : فنی و مهندسی – دانشگاه آزاد اسلامی واحد علوم و تحقیقات نام آزمایشگاه : مجتمع آزمایشگاهی موضوع آزمایش : تعیین و ترسیم دیاگرام سیستم های سه فازی آب – تولوئن – استیک اسید نویسنده : سعیده علیپور لمه اسلام تاریخ آزمایش : 15/12/1390 سال تحصیلی : 91-90 هدف ؛ هدف از انجام این آزمایش ، تعیین و ترسیم دیاگرام فازی برای سیستم سه جزئی شامل آب تولوئن و اسید استیک است ، می باشد . این مواد در فاصله ی تغییرات قابل توجهی از غلظت سیستم مایع تولید یک فاز می کند . ) در مواردی که غلظت اسید استیک کم باشد ، سیستم تولید دو فاز می کند ) . تئوری ؛ ترکیب مخلوط های دوجزئی را می توان روی یکی از محور های مختلف رسم کرد و محور دیگر را برای نشان دادن یک متغیر دیگری مانند درجه حرارت اختصاص داد. در مورد سیستم های سه جزئی خواهیم دید که به کاربردن دیاگرام مثلثی متساوی الااضلاع وسیله بسیار خوبی برای نشان دادن غلظت ها خواهد بود . اکنون طریقه ی رسم نتایج بدست آمده از آزمایش را برروی یک مثلث متساوی الاضلاع بررسی می کنیم . هر ضلع مثلث برای نشان دادن مخلوط دو جزء به کار می رود و می توان آن را به فاصله های مناسب و دلخواه تقسیم کرد که برای مثال در شکل (1) نشان داده شده است ومی توان مشاهده نمود که هر راس مثلث نشان دهنده غلظت صد در صد یکی از اجزاء می باشد . اکنون اگر بخواهیم نقطه ای را که نماینده یک مخلوط با 25% از A و 25% از B و 50% از C باشد پیداکنیم ، باید ابتدا نقطه a را روی ضلع AB تعیین کرده ، بطوریکه نشانه غلظت 25% از A باشد . نقطه a یک خط چین به موازات BC رسم می کنیم تا ضلع مقابل را در C قطع کند . تمام مخلوط هایی که دارای 25% از A هستند در روی این خط قرر دارند . حال نقطه b را که نشانه 50% از C است را روی ضلع AC معین می کنیم و از b یک نقطه چین به موازات AB رسم تا ضلع مقابل را قطع کند . به همین ترتیب روی ضلع AB نقطه نشانه 25% از B را معین می کنیم و خط نقطه چین مربوطه را رسم می کنیم . محل تقاطع این سه خط نقطه چین نقطه ای است که نشان دهنده ترکیب مخلوط است و این نقطه با حرف d در شکل زیر نشان داده شده است . البته واضح است که فقط دو تا از خطوط نقطه چین مذکور برای بدست آوردن نقطه d کافی هستند . روشی که در بالا ذکر شد روش ترسیم بر اضلاع نام دارد . ( شکل (1) ) در مورد ترسیم تولوئن و اسید استیک و آب این نوع دیاگرام را می توان به کار برد . دو تا از اجزاء یعنی آب و تولوئن در هم مخلوط نمی شوند . تولوئن و اسید استیک و از طرف دیگر آب و اسید استیک در هم به هر نسبتی مخلوط می شوند . ابتدا مخلوطی از آب و تولوئن را در نظر می گیریم . این مخلوط شامل دو لایه است . یک لایه از آب که در پایین و یک لایه از تولوئن که در بالا قرار دارد . حال اگر مقدار بیشتری استیک اسید اضافه کنیم ، ترکیب دو لایه تغییر خواهد کرد که به وسیله ی نقاط c و d نشان داده شده است خطی که این دو نقطه را به هم وصل می کند ، خط رابط نامیده می شود . اگر به اضافه کردن استیک اسید ادامه دهیم ، ترکیب دو لایه تغییر کرده و به هم نردیک می شوند ولی نکته ی مهم آن است که مقدار یک فاز مرتبا زیاد و دیگری مرتبا کم می شود ، به طوریکه بالاخره فقط یک لایه باقی می ماند . این لایه در صورت اضافه کردن مقدار بیشتری از اسید هم چنان باقی خواهد ماند . ترکیب درصد ها را در روی یک منحنی که بنام منحنی حلالیت معروف است ، رسم می کنند . ( شکل (2) ) ملاحظه می شود که این منحنی از تولوئن خالص به سمت آب خالص ادامه می یابد . هر مخلوطی که در خارج این سطح باشد ، فقط یک لایه تشکیل خواهد داد و باید دانست که مسیر منحنی با تغییر دادن دما تغییر خواهد کرد و اکنون به مطالعه محلول های a و b که در شکل (2) نشان داده شده و خطی که آن ها را به هم وصل می کند می پردازیم . هر ترکیب کلی که روی این خط باشد تشکیل سیستمی با دو فاز خواهد داد که دارای ترکیب a و b می باشند و مقادیر نسبی دوفاز بستگی به ترکیب کلی دارد . اگر مخلوط کلی دارای آب زیاد باشد ترکیب حاصله روی نقطه ای نزدیک b می افتد ودر این حالت مقدار فاز b از فاز a خیلی بیشتر خواهدبود . برعکس اگر مخلوط کلی دارای مقدار زیاد تولوئن باشد ، ترکیب حاصل در روی خط رابط نزدیک نقطه ی a خواهد بود . این خطوط نه با قاعده و آب موازی هستند و نه با یکدیگر . وقتی که درصد اسید استیک زیاد تر شود ترکیب دو فاز به هم نزدیک می شود و خطوط رابط کوتاهتر می گردند و بالاخره در نقطه ای به نام نقطه ی plait با هم برابر می شوند .
وسایل مود نیاز : 4عدد بورت 50 میلی لیتری برای تولوئن و آب و اسید استیک ، گیره ی بورت ، پایه ی بورت ، 2 عدد قیف جدا کنده ( ( دکانتور) استوانه ای 125 میلی لیتری ، 9 عدد بالون50میلی لیتری ، 4 عدد ارلن 25میلی لیتری ، فنل فتالئین ، سدیم هیدروکسید ( سود) 1نرمال
روش آزمایش : محلول هایی از تولوئن و آب که دارای حجم های 1,2,3,4,5,6,7,8,9 میلی لیتری از آب و تولوئن به صورت جداگانه باشند تهیه می کنیم . حجم کلی هر محلول باید حدود 10 میلی لیتر باشد . این مخلوط را می توان با محاسبه ی مقدار میلی لیترهای لازم مربوط به هر جزء و ریختن آن ها توسط بورت تهیه کرد . این مخلوط ها دو لایه تشکیل می دهند که لایه آب در پایین و تولوئن در بالا قرار دارد و وقتی آن ها را تکان دهیم ، یک دیسپرسیون (معنی) کدر بدست می آید که بلافاصله پس از پایان تکان دادن ، تبدیل به دو فاز اولیه می گردد . اکنون باید این محلول ها را با اسید استیک تیتر کرد تا موقعی که کدری حاصل از تکان دادن از بین برود و در موقع تکان دادن دیگر کدری بوجود نیاید . ترکیب هر محلول را در پایان تیتراسیون محاسبه کنید و دو رشته اعداد بدست آمده را روی دیاگرام های مثلثی رسم می کنیم .
برای دو دکانتور مورد نظر محلول های زیررا تهیه می کنیم :
و بعد از تکان دادن دکانتور ها به مدت 2 دقیقه ، آن ها را یک ساعت به وسیله ی گیره ی بورت آویزان می کنیم . دو لایه تشکیل خواهد شد که لایه ی زیرین آب است که می توان به وسیله ی بازکردن قیف ، از لایه ی بالایی که تولوئن جدا کرد و بعد از جدا کردن ، درصد استیک اسید را در هر لایه به وسیله ی تیتراسیون با سود 1 نرمال تعیین کرد . که برای این کار باید از فاز پایین ( فاز آبی ) حدود 5 گرم را وزن کرده و بقیه را داخل یک بشر جداگانه ریخت و کل فاز بالایی ( فاز آلی ) را دقیقا وزن کرده و هر دو رابا سود 1نرمال تیتر کنید . به کمک اعداد حاصله از تیتراسیون ووزن نمونه ها می توان درصد وزنی استیک اسید را در هر لایه معلوم کرد .
نتایج ؛ حاصل از 9تابالون :
حجم سود مصرفی برای تیترکردن 4تا رارلن حاصل از دو دکانتور : 35.6cc = VNaoH فاز آبی (1) A) 17.2cc = VNaoH فاز آبی (2) B) 10.9cc = VNaoH فاز آلی (1) C) 3.8cc = VNaoH فاز آلی (2) D) 4.96gr = وزن فاز آبی (2) و 4.98 gr = وزن فاز آبی (1) 4.99gr = وزن فاز آلی(2) و 4.97 gr = وزن فاز آلی (1) محاسبات
تاریخ: 23 اسفند 1390برچسب:سیستم های سه فازی, ارسال توسط
سمن صبری / هلیا بهشتی فر آزمایشگاه شیمی عمومی
تمام مواد موجود در طبیعت را به دو گروه بزرگ ماده مخلوط و ماده خالص طبقه بندی می كنند. ادامه این دسته بندی را در نمودار زیر مشاهده كنید. 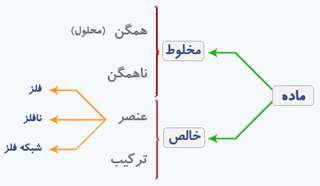
تاریخ: 22 اسفند 1390برچسب:مواد, ارسال توسط
محلول سازی از محلول های غلیظ آزمایشگاه معمولاً در آزمایشگاه محلولها به صورت غلیظ و با درصد خلوص مشخص و استانداردی وجود دارد و برای تهیه محلول های رقیق تر باید از آن ها استفاده کرد. برای این کار از روابط رقیق سازی استفاده می کنیم : در رابطه بالا نیاز است که نرمالیته یا مولاریته محلول غلیظ موجود در آزمایشگاه را تعیین کنیم. برای تعیین نرمالیته از فرمول زیر استفاده می کنیم : نرمالیته محلول غلیظ را بدست آوردیم. در رابطه اول فقط حجم محلول غلیظ (v2) مجهول است که محاسبه می شود و فقط کافی است این مقدار (v1) را از محلول غلیظ برداشته و به حجم مورد نظر (v2) برسانیم. برای تعیین نرمالیته و مولاریته محلول های آزمایشگاهی می توانید از جدول زیر استفاده کنید. که در این صورت فقط به رابطه اول نیاز خواهید داشت. نام محلول چگالی نرمالیته مولاریته اسید استیک %99.5 1.05 17.5 17.5 اسید سولفوریک %98 1.84 36.8 18.4 اسید نیتریک %70 1.42 15.8 15.8 اسید هیدروکلریدریک%40 1.13 22.6 22.6 اسید هیدروکلریدریک %36 1.18 11.65 11.65 اسید هیدروکلریدریک%32 1.16 10.2 10.2 اسید پرکلریک %70 1.67 11.6 11.6 اسید پرکلریک%60 1.54 9.2 9.2 آمونیاک%35 0.88 18.1 18.1 آمونیاک %25 0.91 13.4 13.4 سدیم هیدروکسید %47 1.50 17.6 17.6 تذکر: در مورد اسیدهای غلیظ و قوی مثل اسید سولفوریک همیشه اسید را به آب اضافه می کنیم. (قبل از اضافه کردن اسید مقداری آب مقطر در بالون بریزید و سپس اسید را اضافه کنید). محلول سازی از مواد جامد آزمایشگاه فقط کافی است مقدار ماده جامد بدست آمده را در مقداری آب مقطر حل کرده و به حجم مورد نظر برسانید. تذکر : در مورد برخی مواد جامد که رطوبت جذب می کنند باید دقت شود که از فرمول نوشته شده بر روی برچسب ظرف ماده جرم مولکولی محاسبه شود. مثلاBaCl2 . 2H2O به جرم مولکولی آن دو ملکول آب (36gr) اضافه شده است که باید در محاسبات لحاظ شود. ارسال توسط رومینا
محلول ، يعني مخلوط شدن همگن يا ناهمگن يک يا چند ماده در يک حلال. معمولا براي کار در آزمايشگاه از محلولهاي استاندارد استفاده ميکنند. محلولي را استاندارد مي گويند که در آن ، رابطه بين مقادير ماده حلشده و محلول يا رابطه بين مقدار ماده حلشده و حلال بنحوي معلوم باشد. با معلوم بودن مقدار ماده حلشونده و مقدار حلال تشکيل دهنده محلول ، غلظت محلول مشخص ميگردد. بسياري از واکنشها در حالت محلول انجام ميشوند و محاسبههاي کمي براي اينگونه واکنشها بر مبناي غلظت آنها صورت ميگيرد. محلولي را استاندارد مي گويند که در آن ، رابطه بين مقادير ماده حلشده و محلول يا رابطه بين مقدار ماده حلشده و حلال بنحوي معلوم باشد. با معلوم بودن مقدار ماده حلشونده و مقدار حلال تشکيل دهنده محلول ، غلظت محلول مشخص ميگردد. بسياري از واکنشها در حالت محلول انجام ميشوند و محاسبههاي کمي براي اينگونه واکنشها بر مبناي غلظت آنها صورت ميگيرد. براي بيان غلظت ، روشهاي گوناگوني وجود دارد و محلولهاي استاندارد را براساس غلظت بيان ميکند. محلولهاي استاندارد کاربردهاي زيادي دارند، از جمله در تجزيه هاي تيترسنجي (تيتراسيون) ، واکنشهاي خنثي شدن و واکنشهاي اکسيداسيون-احيا و...
محلولهای استاندارد مورد کاربردمحلول درصد جرمیمحلولی است که در آن مقداری ماده حلشونده در 100 گرم محلول ، حل شده باشد.100*جرم محلول/جرم ماده حل شونده = درصد جرمی
در صورت و مخرج باید از یک نوع یکای جرم استفاده شود. یعنی هر دو باید برحسب میلیگرم ، گرم یا کیلوگرم بیان شوند. مثلا ، بر روی بر چسب محلول شست وشوی دهان نوشته می شود: "محلول استریل سدیم کلرید 9/0 درصد برای شستشو". عبارت "سدیم کلرید 9/0 درصد" یعنی در 100 گرم از این محلول 9/0 گرم سدیم کلرید وجود دارد و بقیه آن آب است. برای محلولهای بسیار رقیق ، معمولا غلظت بر حسب قسمت در میلیون (ppm) بیان میشود. 106*جرم محلول/جرم ماده حل شونده=ppm
اگر حلال ، آب باشد و مقدار ماده حلشونده چنان کم باشد که چگالی محلول همچنان g.mL-1 1,0 باقی بماند، در اینصورت رابطه به قرار زیر خواهد بود: لیتر محلول/میلی گرم ماده حل شونده≈ppm
از ppm برای بیان مقادیر بسیار کم کاتیونها و آنیونها در آب دریا ، بدن جانداران ، بافتهای گیاهی و میزان آلایندههای هوا و بطور کلی ، در مواردی که مقدار ماده حلشونده خیلی جزئی باشد، استفاده میشود. محلول گرم در لیتر (غلظت معمولی-C)در این محلولها ، مقداری ماده حلشونده در یک لیتر محلول وجود دارد.حجم محلول به لیتر/مقدار ماده حل شونده به گرم= C
برای مثال ، اگر در 200 میلیلیتر از محلولی به اندازه 4 گرم پتاسیم کلرید حلشده باشد، غلظت معمولی این محلول ، 20 گرم در لیتر خواهد بود. 200ml*1 L / 1000 ml=0,2 L لیتر محلول
C=4g / 0,2 L=20 g.L-1
محلول مول در لیتر (مولار CM)غلظت مولار رایجترین روش برای بیان غلظت است و محلول مولار ، محلولی است که در هر لیتر آن ، به اندازه یک مول ماده حلشونده ، حل شده باشد. مانند محلول یک مول بر لیتر لیتیم کلرید که در آن ، یک لیتر محلول دارای یک مول لیتیم کلرید است.حجم محلول (لیتر)/مقدار ماده حل شونده (مول)=غلظت مولار (M)
محلول مولال (m)محلولی که در آن یک مول ماده حلشونده در یک کیلوگرم حلال شده باشد، محلول مولال نامیده میشود. از غلظت مولال در مطالعه خواص کولیگاتیو محلولها بکار میرود.مقدار ماده حل شونده (مول)/کیلوگرم حلال= غلظت مولال (m)
برای مثال ، اگر در 200 گرم آب خالص ، 0,03 مول کلرید پتاسیم حل شده باشد، مولالیته محلول عبارت خواهد بود: 200g*1 Kg/1000 g=0,2 Kg کیلوگرم حلال
مولال m=0,03(mol)/0,2Kg=0,15
محلول نرمال (N)محلول نرمال ، محلولی است که یک اکی والان گرم ماده حلشونده در یک لیتر آن و یا یک میلیاکیوالان گرم در هر لیتر آن حل شده باشد.
مقدار n برای اسیدها برابر تعداد هیدروژنهای اسیدی و برای بازها ، برابر تعداد -OH ، برای نمکها برابر ظرفیت فلز ضربدر تعداد فلز و برای واکنشهای اکسایش- کاهش برابر درجه کاهش یا اکسایش است. با بدست آوردن مقدار E (وزن اکی والان) میتوان تعداد اکیوالان را از رابطه زیر حساب کرد: وزن اکی والان/جرم ماده برحسب گرم= =m/E تعداد اکی والان
در نتیجه ، نرمالیته یک محلول بیانگر تعداد اکیوالانها در یک لیتر محلول یا تعداد میلیاکیوالان در هر میلیلیتر محلول میباشد. پس ، یک محلول 0,2 N نقره نیترات ، 0,2 میلی اکی والان (meq) از نقرهنیترات در هر میلیلیتر یا 0,2 اکی والان (eq) در هر لیتر محلول دارد. روابط بین محلول های استانداردCM=C/M
C=NE
N=CM*n
در این روابط: CM مولاریته ، C غلظت گرم در لیتر ، N نرمالیته ، M جرم مولکولی ، E اکی والان گرم و n ظرفیت است. تاریخ: شنبه 20 اسفند 1390برچسب:محلول سازی, ارسال توسط رومینا آخرین مطالب
|
 آمار
وب سایت:
آمار
وب سایت:

