هنگام ایجاد یک پیوند بین دو اتم اوربیتالهای اتمی آنها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها ،الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.
نگاه اجمالی
|
|
اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند. باحروف یونانی σ (سیگما) و π (پی) نمایش میدهند. موقع تشکیل یک پیوند دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی ، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
|
|
|
اوربیتال پیوندی |
|
|
|
اوربیتال ضد پیوندی |
با توجه به نارساییهای نظریه پیوند ظرفیت ، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی ، ترازهای انرژی ، خواص طیفی و ... را به روشنی میتوان توجیه کرد. در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) بر اساس این نظریه ، تمام اوربیتالهای اتم میتواند در تشکیل اوربیتالهای مولکولی شرکت داشته باشد و این اوربیتالها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
|
|
برای مولکول نیز مانند اتم ، ترازهای انرژی در نظر گرفته میشود که الکترونهای مولکول آنها را مطابق اصل آفبا ، اصل طرد پائولی و قاعده هوند (همانند ترازهای انرژی در اتمها) اشغال میکنند. علاوه بر اوربیتالهای پیوندی و غیر پیوندی ، اوربیتالهای ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتالهای اتمی شرکت کننده ، اوربیتالهای مولکول تشکیل میشود.
شرایط همپوشانی اوربیتالها
برای اینکه اوربیتالهای اتمی بتوانند در حد تشکیل پیوند یکدیگر همپوشانی کنند باید دو شرط زیر درباره آنها برقرار باشد:
شرط انرژی
فقط اوربیتالهایی میتوانند با یکدیگر همپوشانی کنند که دریک سطح انرژی قرار داشته و یا سطوح انرژی آنها به اندازه کافی به یکدیگر نزدیک باشد. مثلا اوربیتال p3 یک اتم کلر می تواند فقط با اوربیتال p3 اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال S1 یا S2 و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
|
|
شرط تقارن
فقط اوربیتالهایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از اینرو ، مثلاً اوربیتال S که تقارن کروی دارد، در تشکیل مولکولهای خطی میتواند با اوربیتال P2 که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.
|
|
انواع اوربیتالهای مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند کمتر از هنگامی است که در اوربیتالهای اتمی بوجود آورنده آن قرار گرفته باشند.
|
|
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند بیشتر از هنگامی است که در اوربیتالهای اتمی بوجود آورنده آن قرار گرفته باشند.
|
|
اوربیتال مولکولی غیر پیوندی
هر گاه دو اتم نتوانند به طریقی بهم نزدیک شوند که امکان همپوشانی اوربیتالهای آنها بوجود آید، همپوشانی اوربیتالها صورت نمیگیرد و در نتیجه ، اوربیتالهای اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتالهای مولکولی را نیز با حروف یونانی δ (سیگما) ، π (پی) و ... نشانه گذاری میکنند.
|
|
اوربیتالهای مولکولی سیگما
اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتمها در امتداد یکی از محورها مثلاً x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا S1) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی ، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتالهای سیگما ، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
نمودار تراز انرژی تشکیل اوربیتالهای مولکولی δ 1Sو *δ 1S از اوربیتالهای اتمی S1 دو اتم به شکل زیر میباشد:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است. هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن ، دو الکترون (با اسپینهای جفت شده) اوربیتال δ 1S را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای *δ 1S را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال δ*1S اشغال نشده است. تعداد پیوند (مرتبه پیوند) ، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
|
|
(تعداد الکترونهای ضد پیوندی - تعداد الکترونهای پیوندی) 2/1 = مرتبه پیوند
برای ![]() داریم:
داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم ، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال δ 1S دو الکترون دیگر ناگزیر δ* 1s را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی ![]() عبارتست از:
عبارتست از:
0=(2-2)1/2=مرتبه پیوند
لذا هلیوم به صورت مولکولی ![]() نمیتواند وجود داشته باشد. اثر جدا کننده الکترونهای ضد پیوندی ، اثر اتصال دهنده الکترونهای پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یونهای مولکولی
نمیتواند وجود داشته باشد. اثر جدا کننده الکترونهای ضد پیوندی ، اثر اتصال دهنده الکترونهای پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یونهای مولکولی ![]() و
و ![]() می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال S2 ، اوربیتالهای مولکولی و 2*S δ را بوجود میآورند که با اوربیتالهای δ و *δ ناشی از ترکیب دو اوربیتال S1 مشابهند.
می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال S2 ، اوربیتالهای مولکولی و 2*S δ را بوجود میآورند که با اوربیتالهای δ و *δ ناشی از ترکیب دو اوربیتال S1 مشابهند.
|
|
اما اوربیتالهای مولکولی حاصل از ترکیب اوربیتالهای اتمی P2 کمی پیچیدهترند. سه اوربیتال P2 هر اتم ، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی (![]() و
و ![]() یا
یا ![]() ) صورت گیرد، در نتیجه همپوشانی ، دو اوربیتال مولکولی P δ2 و 2 *P δ را بوجود میآورند .
) صورت گیرد، در نتیجه همپوشانی ، دو اوربیتال مولکولی P δ2 و 2 *P δ را بوجود میآورند .
|
|
اوربیتالهای مولکولی پی (π)
|
|
اگر در تشکیل یک مولکول دو اتمی ، دو اوربیتال اتمی (مثلا ![]() ) از پهلو بهم نزدیک شوند. دو اوربیتال مولکولی ، یکی اوربیتال مولکولی پیوندی پی (π) و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره (*π) را بوجود میآورند. اوربیتالهای π نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو ، به تشکیل اوربیتال π میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال π ، بهم نگهداشتن مولکول است. اوربیتال *π ، در ناحیه بین دو هسته ، چگالی الکترونی کمی دارد. اثر نهایی مولکول *π جدا کردن دو اتم از یکدیگر است.
) از پهلو بهم نزدیک شوند. دو اوربیتال مولکولی ، یکی اوربیتال مولکولی پیوندی پی (π) و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره (*π) را بوجود میآورند. اوربیتالهای π نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو ، به تشکیل اوربیتال π میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال π ، بهم نگهداشتن مولکول است. اوربیتال *π ، در ناحیه بین دو هسته ، چگالی الکترونی کمی دارد. اثر نهایی مولکول *π جدا کردن دو اتم از یکدیگر است.

سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانی اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب ، انرژی هر دو اوربیتال مولکولی σ 2s و σ* 2s پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتالهای اتمی p2 حاصل می شود. انرژی اوربیتالهای σ 2p و σ* 2p پایین تر از انرژی هر یک از دو اوربیتال p2 π می باشد. زیرا میزان همپوشانی اوربیتالهای 2 PX بیشتر از میزان همپوشانی 2 PY و 2 PZ می باشد.
|
|
در مولکولهایی که اوربیتالهای مولکولی σ از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p) ، این همپوشانی اضافی پیوندσ s به ازای تضعیف پیوند σ p ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال σ*s و افزایش انرژی σ* p میشود. بنابراین سطح انرژی σ 2p برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز ![]() و
و ![]() ) پایین تر از سطح انرژی π 2p میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p , s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل
) پایین تر از سطح انرژی π 2p میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p , s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل![]() و
و![]() ) این تاثیر اضافی مساله بوجود نمیآورد.
) این تاثیر اضافی مساله بوجود نمیآورد.
اتم چیست محمد حسینی
اتم کوچکترین واحد تشکیل دهنده یک عنصر شیمیایی است که خواص منحصر به فرد آن عنصر را حفظ میکند. تعريف ديگری آن را به عنوان کوچکترين واحدی در نظر ميگيرد که ماده را ميتوان به آن تقسيم کرد بدون اينکه اجزاء بارداری از آن خارج شود.[۲] اتم ابری الکترونی، تشکیلشده از الکترونها با بار الکتریکی منفی، که هستهٔ اتم را احاطه کردهاست. هسته نیز خود از پروتون که دارای بار مثبت است و نوترون که از لحاظ الکتریکی خنثی است تشکیل شده است. زمانی که تعداد پروتونها و الکترونهای اتم با هم برابر هستند اتم از نظر الکتریکی در حالت خنثی یا متعادل قرار دارد در غیر این صورت آن را یون مینامند که میتواند دارای بار الکتریکی مثبت یا منفی باشد. اتمها با توجه به تعداد پروتونها و نوترونهای آنها طبقهبندی میشوند. تعداد پروتونهای اتم مشخص کننده نوع عنصر شیمیایی و تعداد نوترونها مشخصکننده ایزوتوپ عنصر است. [۳] نظريه فيزيک کوانتم تصوير پيچيده ای از اتم ارائه ميدهد و اين پيچيدگی دانشمندان را مجبور ميکند که جهت توصيف خواص اتم بجای يک تصوير متوسل به تصاوير شهودی متفاوتی از اتم شوند. بعضی وقت ها مناسب است که به الکترون به عنوان يک ذره متحرک به دور هسته نگاه کرد و گاهی مناسب است به آنها عنوان ذراتی که در امواجی با موقعيت ثابت در اطراف هسته (مدار: orbits) توزيع شده اند نگاه کرد. ساختار مدار ها تا حد بسيار زيادی روی رفتار اتم تأثير گذارده و خواص شيميايی يک ماده توسط نحوه دسته بندی اين مدار ها معين ميشود.
ریشه لغوی
این کلمه ، از کلمه یونانی atomos ، غیر قابل تقسیم ، که از a- ، بمعنی غیر و tomos، بمعنی برش ، ساخته شده است. معمولا به معنای اتمهای شیمیایی یعنی اساسیترین اجزاء مولکولها و مواد ساده میباشد.
تاریخچه شناسایی اتم اتم - ملكول - ساختار اتم
از مدتها قبل ،انسان مي داند كه تمام مواد از ذرات بنيادي يا عناصر شيميايي ساخته شده اند. از ميان اين مواد،مثلاً مي توان از اكسيژن ،گوگرد ،و آهن نام برد .كوچكترين ذره آهن ،يك اتم آهن و كوچكترين ذره گوگرد ،يك اتم گوگرد ناميده مي شود .
آهن خالص فقط داراي اتمهاي آهن است و گوگرد خالصل نيز فقط اتمهاي گوگرد دارد . اتمها جرمهاي گوناگوني دارند .سبكترين آنها اتم هيدوژن است .
اتمهاي آهن بسيار سنگينتر از هيدروژن و اتمهاي "اورانيم" از اتمهاي آهن سنگينترند ،يعني جرمشان بيشتر ايت .واژه اتم ،از بان يوناني گرفته شده و معناي آن در واقع "ناكسستني" يا "تقسيم ناپذير" است .
امروزه ما مي دانيم كه امها را هم مي توان به اجزاء كوچكتر تقسيم كرد.ولي به هر حال ،اگر مثلاً يك اتم آهن را درهم بشكنيم ،اجزاء شكسته شده ،و ديگر آهن نسيتند و خصوصيات آهن را ندارند به اين دليل است كه در بسياري از كتابهاي شيمي تعريف زير در باره واژه "اتم" آورده شده است : "يك اتم كوچكترين سنگ بناي يك عنصرشيميايي است كه كليه خصوصيات ويژه آن عنصر را دارا بوده و در صورت تقسيم آن به اجزاء كوچكتر ،اين خصوصيات را از دست خواهد داد ".
اتمها در مقايسه با كليه چيزهايي كه ما در زندگي معمولي خود با آنها برخورد مي كنيم ،خيلي خيلي كوچك هستند .قطر يك اتم تقريباً سانتيمتر يا 8 - 10×1 سانتيمتراست . با ذكر يك مثال مي توان پي برد كه اتمها چقدر كوچك هستند : برروي كره زمين تقريباً 5 ميليارد نفر زندگي مي كنند. اگر هر نفر را يك اتم حساب كنيم و با اين اتمها يك زنجير بسازيم طول اين زنجير به زحمت 50 سانتيمتر خواهد شد .
مولكول چيست؟ اتمها مي توانند براي ايجاد ذرات بزرگنر با يكديگر پيوند پيدا كنند و به اصطلاح "مولكولها " را تشكيل دهند.به عنوان مثال ،دو اتم اكسيژن با يكديگر تشكيل يك مولكول اكسيژن را مي دهند. در طبيعت اغلب اوقات اتفاق مي افتد كه امهاي عناصر مختلف به صورت مولكول با يكديگر اتحاد مي يابند . يكي از معروفترين اين اتحادها مولكول آب است . كه ازيك اتم اكسيژن و دو اتم هيدوژن تشكيل شده است . يك مولكول آمونياك ،يك اتم نيتروژن وسه اتم هيدوژن دارد .
آب و آمونياك برخلاف اكسيژن و كربن عناصر شيميايي نيستند بلكه تركيبات شيميايي از عناصر متقاوت هستند .كوچكترين ذره چنين تركيبي مولكول ناميده مي شود .چنانچه يك مولكول آب را تجزيه كنيم خصوصيات آب از دست مي رود و فقط ذرات تشكيل دهنده آن يعني هيدروژن و اكسيژن باقي مي مانند كه خصوصياتي كاملاً متفاوت با آب دراند . مولكولهانيز مثل اتمها به طرز غيرقابل تصوري كوچك هستند دريك ليوان ـآب معمولي تقريباً 6000000000000000000000000 يا 24 10×6 مولكول آب وجود دارد . اگر اين لوان آب را به ميزان مساوي بر روي تمام اقيانوسها و درياهاي كره زمين پخش كنيم درهر ليتر از آب درياها ،چندين هزار مولكول از آب ليوان وجود خواهد داشت .
ساختار اتم چيست ؟ تقريباً 75سال پيش "ارنست رادر فورد " در انگلستان مطلبي را كشف كرد كه فيزيك اتمي جديد را نبيان گذارد . اما اكنون به اين مطلب مي پردازيم .اين فيزيكدان بريتانيايي يك ورق نازك طلايي را مورد اصابت ذرات آلفا قرار داد تا در ون اتمها را شناسايي كند . اگر مواد در يك چنين ورق فلزي بطور متناسب و يكنواخت پخش بودند ذرات آلفا درهمان مسير پرواز خود به حركت ادامه مي دادند،اگر چه در اين حالت كمي از سرعت ذرات آلفا كاسته مي شد. تمام "ذرات آلفا" تقريباً به همين شكل رفتار كردند .البته تعداد كمي نيز كاملاً از مسير خود منحرف شدند درست مثل اينكه به يك گلوله كوچك اما خيلي سنگين برخورد كرده باشند "رادرفورد " از اين آزمايش چنين نتيجه گيري كرد كه تقريبا تمام جرم اتم طلا در يك هسته بسيار كوچك وناچيز تمركز يافته است .
هسته اتم كشف شده بود.امروز ه ما دقيقاً مي دانيم ساختار اتم چيست ."اتم ماننديك منظومه شمسي كوچك است ". در مركز اتم يك هسته بسيار كوچك قرار دارد كه از نظر الكتريكي داراي با ر مثبت است و تقريباً تمام جرم اتم را تشكيل مي دهد به دور اين هسته ذرات كوچك و بسيار سبكي كه داراي بار الكتريكي منفي هستند يعني الكترونها در حركت هستند. اتمها ي سنگين تر ين فلزات در وقاع داراي "ساختماني اسفنجي " هستند و تقريبا فقط از فضاي خالي تشكيل شده اند اگر هسته اتم را به برزگي يك گيلاس فرض كنيم ،ساختمان اتم با مدارهاي اكتروني خود تقريبا به بزرگي "كليساي دم " در شهر كلن خواهد بود .
قطر هسته اتم تقريبا برابر سانتيمتر يا 12- 10سانتيمتر مي باشد به عبارت ديگر 100ميليارد هسته اتم دركنار هم زنجيري به طول يك ميليمترخواهند ساخت . ساده ترين اتم هيدروژن است . دراين اتم فقط يك الكترون به دور هسته بسيار كوچكي مي گردد . در شرايط عادي اين اكترون فقط پنج ميليارددم سانتيمتر يا 9- 10×5 سانتيمتر از هسته فاصله دارد .اما اين الكترون مي تواند روي مدارهاي دور تري نسيت به هسته نيز قرار گيرد و در اينجاست كه متاسفانه و جه تشابه بين اتم و منظومه شمسي از بين مي رود .
حركت الكترون فقط روي مدارهاي ويژه و معين يا به عبارت ديگر"تراز انرژي " مشخصي امكان پذير مي بادش در حالي كه سياره ها در هر فاصله دلخواهي از خورشيد مي توانند حركت كنند مثلا اگريك الكترون از يك مدار داخلي يا به عبارت ديگراز يكتراز پر انرژي تر به يك مدارداخلي يا يك تراز كم انرژي تر منتقل شود مقدار انرژي به شكل يك ذره يا "كوانت نوري " يا "فوتون" رها مي وشد چون فقط مدارها يا ترازهاي انرژي كاملاً معيني وجود دارد در نتيجه فقط ذره هاي نوري يا انرژي كاملاً معيني نيز منتشر خواهند شد و به عبارت ديگردرنمودار موجي طول موجهاي كاملا معيني پديدار مي شوند كه انسان ار روي آنها مي تواند درتمام كيهان يك انم هيدروژن را باز شناسايي كند.
اين مطلب براي ساير عناصر شيميايي نيزصادق است زير بناي علم "طيف نگاري و طيف شناسي " مي باشد كه به كمك آن مثلا مي توان تشخيص داد چه نوع اتمهايي در آتمسفر خورشيد وجود دارند . مواد متنوعی که روزانه در آزمایش و تجربه با آن روبه رو هستیم، متشکل از اتمهای گسسته است. وجود چنین ذراتی برای اولین بار توسط فیلسوفان یونانی مانند دموکریتوس (Democritus) ، لئوسیپوس (Leucippus) و اپیکورینز (Epicureanism) ولی بدون ارائه یک راه حل واقعی برای اثبات آن ، پیشنهاد شد. سپس این مفهوم مسکوت ماند تا زمانیکه در قرن 18 راجر بسکوویچ (Rudjer Boscovich) آنرا احیاء نمود و بعد از آن توسط جان دالتون (John Dalton) در شیمی بکار برده شد.
راجر بوسویچ نظریه خود را بر مبنای مکانیک نیوتنی قرارداد و آنرا در سال 1758 تحت عنوان: Theoria philosophiae naturalis redacta ad unicam legem virium in natura existentium چاپ نمود. براساس نظریه بوسویچ ، اتمها نقاط بیاسکلتی هستند که بسته به فاصله آنها از یکدیگر ، نیروهای جذب کننده و دفع کننده بر یکدیگر وارد میکنند. جان دالتون از نظریه اتمی برای توضیح چگونگی ترکیب گازها در نسبتهای ساده ، استفاده نمود. در اثر تلاش آمندو آواگادرو (Amendo Avogadro) در قرن 19، دانشمندان توانستند تفاوت میان اتمها و مولکولها را درک نمایند. در عصر مدرن ، اتمها ، بصورت تجربی مشاهده شدند. ا
ندازه اتم
اتمها ، از طرق ساده ، قابل تفکیک نیستند، اما باور امروزه بر این است که اتم از ذرات کوچکتری تشکیل شده است. قطر یک اتم ، معمولا میان 10pm تا 100pm متفاوت است.
ذرات درونی اتم
در آزمایشها مشخص گردید که اتمها نیز خود از ذرات کوچکتری ساخته شدهاند. در مرکز یک هسته کوچک مرکزی مثبت متشکل از ذرات هستهای ( پروتونها و نوترونها ) و بقیه اتم فقط از پوستههای متموج الکترون تشکیل شده است. معمولا اتمهای با تعداد مساوی الکترون و پروتون ، از نظر الکتریکی خنثی هستند.
طبقهبندی اتمها
اتمها عموما برحسب عدد اتمی که متناسب با تعداد پروتونهای آن اتم میباشد، طبقهبندی میشوند. برای مثال ، اتم های کربن اتمهایی هستند که دارای شش پروتون میباشند. تمام اتمهای با عدد اتمی مشابه ، دارای خصوصیات فیزیکی متنوع یکسان بوده و واکنش شیمیایی یکسان از خود نشان میدهند. انواع گوناگون اتمها در جدول تناوبی لیست شدهاند. اتمهای دارای عدد اتمی یکسان اما با جرم اتمی متفاوت (بعلت تعداد متفاوت نوترونهای آنها) ، ایزوتوپ نامیده میشوند.
سادهترین اتم
سادهترین اتم ، اتم هیدروژن است که عدد اتمی یک دارد و دارای یک پروتون و یک الکترون میباشد. این اتم در بررسی موضوعات علمی ، خصوصا در اوایل شکلگیری نظریه کوانتوم ، بسیار مورد علاقه بوده است.
واکنش شیمیایی اتمها
واکنش شیمیایی اتمها بطور عمدهای وابسته به اثرات متقابل میان الکترونهای آن میباشد. خصوصا الکترونهایی که در خارجیترین لایه اتمی قرار دارند، به نام الکترونهای ظرفیتی ، بیشترین اثر را در واکنشهای شیمیایی نشان میدهند. الکترونهای مرکزی (یعنی آنهایی که در لایه خارجی نیستند) نیز موثر میباشند، ولی بعلت وجود بار مثبت هسته اتمی ، نقش ثانوی دارند.
پیوند میان اتمها
اتمها تمایل زیادی به تکمیل لایه الکترونی خارجی خود و (یا تخلیه کامل آن) دارند. لایه خارجی هیدروژن و هلیم جای دو الکترون و در همه اتمهای دیگر طرفیت هشت الکترون را دارند. این عمل با استفاده مشترک از الکترونهای اتمهای مجاور و یا با جدا کردن کامل الکترونها از اتمهای دیگر فراهم میشود. هنگامیکه الکترونها در مشارکت اتمها قرار می گیرند، یک پیوند کووالانسی میان دو اتم تشکیل میگردد. پیوندهای کووالانسی قویترین نوع پیوندهای اتمی میباشند.
یون
هنگامیکه بوسیله اتم ، یک یا چند الکترون از یک اتم دیگر جدا میگردد، یونها ایجاد میشوند. یونها اتمهایی هستند که بعلت عدم تساوی تعداد پروتو نها و الکترونها ، دارای بار الکتریکی ویژه میشوند. یونهایی که الکترونها را برمیدارند، آنیون (anion) نامیده شده و بار منفی دارند. اتمی که الکترونها را از دست میدهد کاتیون (cation) نامیده شده و بار مثبت دارد.
پیوند یونی
کاتیونها و آنیونها بعلت نیروی کولمبیک (coulombic) میان بارهای مثبت و منفی ، یکدیگر را جذب مینمایند. این جذب پیوند یونی نامیده میشود و از پیوند کووالانسی ضعیفتر است
مرز مابین انواع پیوندها
همانطور که بیان گردید، پیوند کوالانسی در حالتی ایجاد میشود که در آن الکترونها بطور یکسان میان اتمها به اشتراک گذارده میشوند، درحالیکه پیوند یونی در حالی ایجاد میگردد که الکترونها کاملا در انحصار آنیون قرار میگیرند. بجز در موارد محدودی از حالتهای خیلی نادر ، هیچکدام از این توصیفها کاملا دقیق نیست. در بیشتر موارد پیوندهای کووالانسی ، الکترونها بطور نامساوی به اشتراک گذارده میشوند، بطوریکه زمان بیشتری را صرف گردش بدور اتمهای با بار الکتریکی منفیتر میکنند که منجر به ایجاد پیوند کووالانسی با بعضی از خواص یونی میگردد بطور مشابهی ، در پیوندهای یونی ، الکترونها اغلب در مقاطع کوچکی از زمان بدور اتم با بار الکتریکی مثبتتر میچرخند که باعث ایجاد بعضی از خواص کووالانسی در پیوند یونی می گردد.
دوستان عزیز
با عرض پوزش
دسترسی به ایمیل در حال حاضر غیر ممکن شده
لطفا در صورت عدم اپلود گزارشکارها در وبلاگ لطفا کپی گزارش خودرا در روز ازمایش خود به همراه داشته باشید.
با تشکر
شکیبازاده
الکترون اوژه
الکترون اوژه نوعی الکترون آزاد است که از اتم یا یون گسیل میشود. هنگامیکه الکترونی، اتم را ترک کند، یک جای خالی از خود بجا میگذارد. الکترونهای لایههای بالاتر که پرانرژیترند میتوانند به این جای خالی رفته و انرژی آزاد کنند. انرژی آزاد شده میتواند به دو گونه باشد، یا بصورت فوتون تابش شود و یا به الکترون دیگری منتقل شده و باعث شود آن الکترون از اتم به بیرون پرتاب شود. الکترونی که بدینگونه از اتم خارج میشود را الکترون اوژه گویند.
طیف سنجی الکترون اوژه
روش اوژه روشی برای مطالعه سطح بوده که در آن چشمه ابتدایی بمباران بجای پرتو ایکس پرتو الکترون است. با تابش پرتوالکترونی به سطح نمونه مجهول، الکترونهای معروف به الکترون اوژه، از سطح نمونه خارج شده و با اندازه گیری انرژی جنبشی آن ها، می توان نوع عنصر را در سطح تعیین کرد. باید توجه نمود که پس از خروج الکترون (به عنوان مثال ازمدارK) جایگزینی الکترون ازمدار بالاتر(به عنوان مثالL) امکان پذیر میگردد.

![]()
اجزای اصلی دستگاه اوژه:
ü محفظه خلا
ü تفنگ الکترونی
ü تفنگ یونی
ü تفکیک کننده
ü آشکارساز
طیف های اوژه:
1. به شکل مستقیم که سیگنال کل الکترون ها بر حسب تابعی از انرژی جنبشی الکترون هایی که نمونه را ترک می کنند.
2. به شکل مشتق سیگنال الکترون ها بر حسب تابعی از انرژی جنبشی. مشتق گیری از طیف به برجسته کردن سیگنال اوژه یا از بین بردن زمینه که به علت الکترون های ثانویه و برگشتی ایجاد می شود، کمک می کند.
کاربردها:
آنالیز ترکیبی منطقه 3 تا 5 نانومتر نزدیک سطح برای تمام عناصر بهجز هیدروژن و هلیم
رسم منحنی عمق – ترکیب و آنالیز فیلم نازک
آنالیزمرزدانه و دیگر سطوح مشترک به وجود آمده به وسیله ترک
تشخیص فازها در مقاطع میانی
آنالیز اتمهای سبک
محدودیت ها:
اوژه فرآیندی است که حد اقل به 3 الکترون نیاز دارد، بنابراین توانایی آنالیز هیدروژن و هلیوم را ندارد.
نیاز به خلا بسیار بالا 10-9.
نمونه هایی که تست می شوند باید با شرایط خلا سازگاری داشته باشند. به طور مثال برای نمونه ای شامل Zn به علت فشار بالای بخار آن مناسب نیست.
حساسیت ردیابی کمی برای بیشتر عناصر از 0.1 تا ۱ درصد اتمی است.
طيفسنجي الكترون اوژه (AES)
طيفسنجي الكترون اوژه (AES)
روش اوژه روش ديگري براي مطالعه سطح بوده كه در آن چشمه ابتدايي بمباران، به جاي پرتو X پرتو الكترون است. اساس اين روش در شكل زیر مشاهده ميشود.

با تابش پرتو الكتروني به سطح نمونه مجهول الكترونهاي معروف به الكترون اوژه از سطح نمونه خارج شده و با اندازهگيري انرژي جنبشي آنها ميتوان نوع عنصر را در سطح تعيين كرد. بايد توجه نمود كه پس از خروج الكترون (به عنوان مثال از مدار K) جايگزيني الكترون از مدار بالاتر (به عنوان مثال L) امكانپذير ميگردد. براي آنكه اتم به حالت الكتروني پايدار ابتدايي برگردد بايد انرژي برانگيختگي خود را يا به طريق تابش فوتون (پديده XPS) و يا با انتقال اين انرژي به الكترون ديگر از دست بدهد. اگر حالت اول پديد آيد پرتو X مشخصه اتم پديد ميآيد و اگر حالت دوم صورت پذيرد الكترون خروجي را الكترون اوژه و اين پديده را نيز پديده اوژه مينامند.
مطابق رابطهاي كه براي روش XPS توضيح داده شد با توجه به شكل بالا ميتوان رابطه زير را نيز براي پديده اوژه نوشت:
EAuger=EK-EL2-EL3
EAuger انرژي جنبشي الكترونهاي اوژه خروجي EL2 ، EK و EL3 انرژي مدارهاي اتمي هستند.
در رابطه بالا EL2 و EK انرژي ابتدايي پديد آمده در اتم است كه بايد يا به پرتو تبديل شود و يا صرف كندن الكترون مدار نزديك به خود (به عنوان مثال EL3) بشود. به عبارت ديگر مقداري از اين انرژي صرف غلبه بر پيوند الكترون در مدار خود (يعني EL3) و مقداري صرف پديد آمدن انرژي جنبشي در آن الكترون ميشود. حال اگر بتوان مقدار EAuger را اندازهگيري كرد مقدار EK-EL2-EL3 به دست ميآيد و از آنجا كه اين مقدار براي هر اتم معين است ميتواند مشخصه آن اتم باشد. در حقيقت با تعيين انرژي جنبشي الكترونهاي اوژه خروجي از سطح نمونه ميتوان نوع اتم موجود در سطح را تعيين كرد و يا به عبارت ديگر آناليز عنصري سطحي را انجام داد. در اين پديده به هنگام خالي شدن اربيتال K ممكن است انتقال الكتروني از مدارهاي ديگر غير از مدار L نيز پديد آيد و همچنين خروج الكترون اوژه از مدار ديگر غير از آنچه در مثال بالا اشاره شد صورت پذيرد. بنابراين در پديده اوژه براي يك اتم انتقالهاي گوناگوني وجود دارد و به هر حال در هر انتقال دست كم 3 مدار اتمي درگير هستند. براساس آنچه كه در مثال بالا به آن اشاره شد اين انتقال KLL ناميده ميشود. نكته جالب در پديده اوژه وابسته نبودن انرژي الكترونهاي اوژه به انرژي چشمه ابتدايي برانگيختگي است. اين نكته در مقايسه با پديده XPS كه در آن انرژي فوتوالكترونها تابع مقدار انرژي ابتدايي چشمه برانگيختگي بود قابل توجه است. به هنگام برانگيختگي يك اتم، پديدههاي گوناگوني مانند پديده اوژه و XRF در كنار هم و در رقابت با يكديگر صورت ميگيرد و به عبارت ديگر، برحسب عدد اتمي و محيط شيميايي اتم موجود در نمونه درصدي از اتمها با پديده اوژه و درصد ديگري با پديد آمدن پرتو مشخصه (XPS) پس از برانگيختگي به حالت پايدار اتمي ميرسند. با كاهش عدد اتمي بخت پديده اوژه بيشتر از پديده XRF ميشود در حالي كه در اتمهاي سنگين پديده XRF حاكم بوده و الكترونهاي اوژه بسيار ناچيزند.اين نكته از ديدگاه آناليز شيميايي عنصرهاي سبك به كمك روش XRF همواره با مشكلات زيادي همراه است و قابل توجه ميباشد. به زبان ساده، روش اوژه براي آناليز اتمهاي سبك موثر بوده و ميتواند به جاي روش XRF به خدمت گرفته شود. اجزاي دستگاه اوژه مانند اجزاي دستگاه XPS است. در يك محفظه بدون هوا (با فشار 10-5- 10-10 torr) نمونه مجهول توسط پرتو الكتروني بمباران شده و الكترونهاي اوژه پديد آمده به داخل يك تفكيك كننده الكترواستاتيكي مانند آنچه در روش XPS توضيح داده شد هدايت ميشوند. تفكيك كننده الكترونها را براساس انرژي جنبشي كه دارند جدا ميكند و شدت پرتو الكتروني توسط يك آشكارساز الكتروني اندازهگيري ميشود. (مطابق شکل زیر)

محفظه نگهدارنده نمونه علاوه بر تفنگ الكتروني مجهز به بمباران كننده يوني نيز ميباشد تا بتوان به اين وسيله لايه برداري از سطح نمونه و آناليز در عمق را نيز انجام داد. آنچه در دستگاه اوژه به عنوان طيف اوژه رسم خواهد شد در شكل زیر ديده ميشود. (برای قطعه ی فولادی که سطح آن غیرفعال شده)
از آنجا كه جمعيت الكترونهاي اوژه كم بوده و شدت پرتو ناچيز است با رسم مشتق شدت پيكهاي قويتري به دست خواهد آمد.
همانطور كه اشاره شد در روش اوژه از بمباران الكتروني استفاده ميشود بنابراين آناليز سطح در اين روش در مقايسه با روش XPS محدود به چند لايه سطحي است. به عبارت ديگر در محدوده حداكثر 20 آنگسترومي سطح خواهد بود. از طرف ديگر در روش اوژه از الكترون به عنوان چشمه برانگيختگي استفاده ميشود. بنابراين ميتوان با ايجاد پديده روبش مانند آنچه در روش ميكروسكوپ الكتروني روبشي SEM به كار ميرود از سطح نمونه تصويربرداري كرد.اين روش ميكروسكوپ روبشي اوژه SAM ناميده ميشود
گاز ایدهآل یک تقریب از گازهای حقیقی است که برای مقاصد محاسباتی بکار میرود. گاز ایدهآل به گازی گفته میشود که:
- بین ذرات آن نیرویی وجود نداشته باشد و تنها برهمکنش بین ذرات، برخورد صلب باشد.
- اندازهٔ ذرات نسبت به مسیر آزاد میانگین ناچیز باشد.
گازهای حقیقی را در چگالیهای پایین با تقریب خوبی میتوان ایدهآل فرض کرد.
گازهای ایدهآل در حالت تعادل داخلی از معادلهٔ گاز ایدهآل پیروی میکنند:
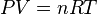
که در آن P فشار داخلی سیستم، V حجم سیستم، n تعداد مولهای ذرات سیستم، R ثابت جهانی گازها و T دمای سیستم با یکای کلوین است.
رای اثبات این قانون، اول لازم است که با قانونهای بویل و شارل آشنا شویم .
قانون بویل
رابطهٔ بین فشار و حجم یک گاز در 1662 میلادی توسط رابرت بویل ( Robert Boyle ) اندازه گیری شد . بویل متوجه شد که افزایش فشار وارد شده بر یک گاز با کاهش حجم آن متناسب است . اگر فشار دو برابر شود، حجم به نصف کاهش مییابد . اگر فشار سه برابر شود، حجم به یک سوم حجم اولیه اش میرسد . قانون بویل میگوید که در دمای ثابت، حجم گاز با فشار رابطهٔ عکس دارد :

قانون شارل
رابطهٔ بین حجم و دمای یک گاز در 1787 میلادی توسط ژاک شارل ( Jacques Charles ) مطالعه شد و نتایج او به طور قابل ملاحظهای توسط شاگردانش ژوزف گیلوساک ( Joseph Gay - Lussac ) گسترش یافت . براساس این قانون حجم تمام گازها، در فشار ثابت، با دمای مطلق آن گاز رابطهٔ مستقیم دارد :

قانون گازهای ایده آل
در دما و فشار ثابت حجم یک گاز با تعداد مولهای آن نسبت مستقیم دارد . حجم یک مول گاز نصف حجم اشغال شده توسط 2 مول گاز میباشد . بنابراین قانون و قوانین بویل و شارل میتوان گفت که :

با استفاده از یک عدد ثابت میتوان تناسب را به تساوی تبدیل کرد :

که از آن نتیجه میشود :
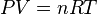
قانون گازهای ایده آل توسط نظریهٔ جنبشی گازها
نمونهای از یک گاز شامل N (عدد آووگادرو) مولکول، هر کدام با جرم m را در نظر بگیرید. اگر این نمونه در مکعبی با یال a باشد، حجم آن برابر خواهد شد با:
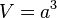
با فرض اینکه یک سوم مولکولها در جهت محور x، و دو سوم در جهت محورهای y و z حرکت کنند، آنگاه در هر ۲a حرکت یک مولکول گاز در جهت محور x داخل مکعب، مولکول حداقل یکبار به دیوارهٔ مکعب برخورد میکند. با فرض اینکه سرعت میانگین هر مولکول گاز برابر u است، در هر ثانیه هر مولکول گاز به اندازهٔ  برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند :
برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند :
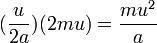
از این رو برای تمام مولکولهای گاز میتوان نوشت :

فشار عبارت است از نیرو بر سطح. پس :

پس میتوان نوشت :
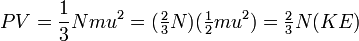
که KE در آن میانگین انرژی جنبشی مولکولی گاز میباشد. و از آنجا که انرزی جنبشی یک گاز (بنابر نظریه جنبشی گازها) با دمای مطلق آن نسبت مستقیم دارد و همچنین  ، پس :
، پس :

که با ضرب کردن عدد ثابتی مثل R، میتوان تناسب را به تساوی تبدیل کرد :
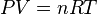
معادله حالت گاز برای گاز غیر کامل
معادله واندروالس:
که a و b ضرایب واندوالس نام دارن و مقدارشون مربوط میشه به ماهیت گاز مورد نظر
کاهش فشار ناشی از نیروهای جاذبه بین مولکولی، از مقدار ایدهآل آن است؛ b حجم تکمیلی است و حجم اشغال شده توسط مولکولها را به حساب میآورد و داری مقداری در حدود چهار برابر حجم واقعی مولکولهاست. و به این معادله به افتخار کاشف آن معادله وان در والس (به انگلیسی: Van der Waals equation) اطلاق میگردد.
گاز ها چون طبق نظریه ی انرژی جنبشی عمل نمی کنند از معادله انحراف نشون می دن که بدلیل عدم احتساب برهمکنش های بین ذره ای و نیز حجم خود ذره می باشد
برای تصحیح این انحراف یک معادله ی عمومی به اسم معادله ی ویریال طرآحی(و اثبات)شده که به این صورت می باشد:
اثبات این معادله نیز با استفاده از علم مکانیک آماری صورت می گیرد
هر کدام از ضرایب ویریال نیز دربرگیرنده ی احتمال برخورد های به ترتیب صفر ، یک ،دو ، ... مولکولی هستند.
عدد یک در واقع ضریب صفرم می باشد(=1)
در صورتی که گاز ایده آل باشد،بقیه ی ضریب ها بدلیل صفر بودن برهمکنش ها برابر صفر شده که معادله ی گاز ایده آل بدست می آید
این معادله نیز در دمای بالا و فشار بالا بدلیل اثر قابل توجه ضرایب دیگر قابل استفاده نیست.(البته این را مطمئن نیستم)
معادله ی واندوالس نیز از این معادله استفاده شده که دو ضریب اول و دوم ویریال را در نظر می گیرد و از بقیه صرف نظر می کند این تقریب در ضریب a معادله قابل مشاهده است که فقط برخورد های دو مولکولی را در نظر می گیرد که البته در محدوده ی قابل توجهی از شرایط ترمودینامیکی تقریب خیلی خوبی می باشد.
وقتی تغییر فاکتور تراکم پذیری بر حسب فشار برای گارهای حقیقی در یک دمای ثابت رو رسم کردن دیدن که میشه این فاکتور رو به صورت تابعی از فشار در معادله ای به شکل معادله ویریال بيان كرد. در واقع وقتی معادله به این شکل در نظر گرفته بشه مطابقت خوبی با داده های تجربی داره.. اینکه چرا اینطوریه سوال خوبی نیست! اکثر معادلات با بررسی داده های تجربی به دست اومدن و به مرور تصحیح شدن... مثالش هم معادله معروف آرنیوس! غیر از معادله وان در والس معادله های دیگه ای هم برای گازهای حقیقی معرفی شده از جمله وان دروالس. برتلو. دایتریچی و ...
حتما همه راجب جنبش مولکولی می دانید که هر ماده ای از مولکولهایی تشکیل شده که
مدام در حال تماس با یکدیگرند.
حتی خود بدن انسان از سلولها و گلوبولهایی تشکیل شده که مدام در حال برخورد و
تبادل با هم هستند.
تا به حال به جایی شلوغ مانند میدان و خیابان انقلاب یا امام حسین و امثال آن دقت کرده
اید که چقدرازدحام جمعیت و حرکت آدمها از میان همدیگر شبیه همان جنبش مولکولی
است . خرید کردن ،حرف زدن ،نگاه کردن و حتی گاهی بی حواس به یکدیگر برخورد
کردن .
ودر دوستی ها وخانواده ها انتقال عواطف و احساساتها مانند غم ،شادی ،عشق، محبت،
نفرت،مهربانی، دوست داشتن و غیره و یا تاثیرات عمکلردهای ما در زندگی و یا
روحیات هرکس چه منفی یا مثبت و کارهایی که برای همدیگر انجام میدهیم شبیه یا
همان جنبش مولکولی است.
بنابراین اگر مولکولی انرژی را از ما دریافت کند آنرا به شکلی در جای دیگر خرج
می کند و در همان لحظه هم از همان یا مولکولی دیگربه نوعی انرژی را دریافت می
کنیم خواه مثبت یا منفی.
در نتیجه اگر همه مولکولها کارشان را درست انجام بدهند و تبادل انرژی های مفید وبه
موقع انجام گیرد آن شیئ یا جسم ،عمکرد صحیح و سالمی خواهد داشت وبعد یک
دستگاه در یک سیستم وبعد آن سیستم ودرنهایت کل یک مجموعه ،رویه و کارکرد سالم
و درستی خواهد داشت.
........................................................................................................................................................
جنبش مولکولی
جنبش مولکولی در واقع به حرکت مولکولها گفته می شود.
انواع جنبش
جنبش مولکولها در سه نوع کاتوره ای، چرخشی و لرزشی می باشد. در واقع هر حالت ماده، یک نوع جنبش دارد:
- در گازها جنبش به صورت کاتوره ای می باشد.
- در مایعها جنبش بصورت لرزشی و چرخشی می باشد.
- در جامدها جنبش به صورت لرزشی می باشد.
........................................................................................................................................................
نظریه جنبش مولکولی گازها
این نظریه بر چند اصل زیر استوار است :
۱- همه گازها از ذره ها یبسیار کوچکی (اتم یا مولکول ) تشکیل شده اند . ذره هایی که می توان حجم آن ها را در مقایسه ، حجم کل گاز نادیده گرفت .
۲- اتم ها یا ملوکول های گاز پیوسته در حرکتند ، آن ها اغلب با یکدیگر و با دیواره ظرفشان برخورد می کنند . فشار یک گاز قوی نتیجه ی برخورد ذره های سازنده آن ، با دیوار ظرف است .
۳- ذره های یک گاز به هنگام برخورد با یکدیگر می توانند بخشی از انرژی جنبشی خود را از دست بدهد یا به آن بیافزاید اما مقدار کل انرژی جنبشی آنها تغییر نمی کند .
۴- در یک دمای معین میانگین انرژی جنبشی ذرات سازنده گاز ثابت است .
به گازهایی که رفتار آنها با توچه به نظریه جنبش مولکولی گازها قابل پیش بینی است گازهای ایده آل می گوین
|
مقدمه:
در این نوشته هدف اصلی توجیه اثر متقابل فوتون و گراویتون با توجه به نظریه سی. پی. اج. است. نخستین برخورد ها با اثر فوتوالکتریک از دیدگاه الکترومغناطیس کلاسیک صورت گرفت که توانایی توجیه آن را نداشت. سپس انیشتین این پدیده را با توجه به دیدگاه کوانتومی توجیه کرد. بنابراین نخست میدانها و امواج الکترومغناطیسی کلاسیک را بطور فشرده بیان کرده، آنگاه با ذکر نارسایی آن به تشریح پدیده فوتوالکتریک از دیدگاه انیشتین می پردازم و سرانجام هر سه اثر فوتوالکتریک، اثر کامپتون و تولید و واپاشی زوج ماده - پاد ماده را با توجه به نظریه سی. پی. اچ. بررسی خواهم کرد. و سرانجام تلاش خواهد شد تا وحدت نیروهای الکترومغناطیس و گرانش را نتیجه گیری کنیم.
نیروهای الکتریکی و مغناطیسی
نیروهای بین بارهای الکتریکی را می توان به دو نوع تقسیم کرد. دو بار نقطه ای ساکن یا متحرک به یکدیگر نیروی الکتریکی وارد می کنند که از رابطه ی زیر به دست می آید
Fe=kqQ/r2
که در آن
وقتی دو بار الکتریکی نسبت به ناظری در حرکت باشند، علاوه بر نیروی الکتریکی، نیروی مغناطیسی نیز بر یکدیگر وارد می کنند. از آنجاییکه بررسی نیروها با استفاده از مفاهیم میدان عمیق تر و ساده تر است، می توان گفت که هر بار الکتریکی در اطراف خود یک میدان الکتریکی ایجاد می کند که شدت آن در فاصله r از آن، از رابطه ی زیر به دست می آید:
E=kq/r2
حال اگر ذره ی باردار حرکت کند، در اطراف آن علاوه بر میدان الکتریکی، یک میدان مغناطیسی نیز ایجاد می شود که وجود چنین میدان مغناطیسی بصورت تجربی قابل اثبات است. اگر ذره ای با بار الکتریکی q در یک میدان مغناطیسی B و با سرعت v حرکت کند، نیرویی بر آن وارد می شود که بر صفحه ی B, v عمود است که از رابطه ی زیر به دست می آید:
F=qvxB
از این رو، بار q که به فاصله ی r از Q قرار دارد و با سرعت v حرکت می کند، یک میدان مغناطیسی در محل Q تولید می کند که از رابطه ی زیر به دست می آید:
بطور خلاصه، در نقطه ای که میدان الکتریکی و مغناطیسی E , B وجود دارد، نیروی الکترومغناطیسی وارد بر ذره ی باردار، با بارq که با سرعت v حرکت می کند برابر است با:
|
|
|---|
|
میدانهای الکترومغناطیسی
در یک میدان الکتریکی موجود در فضا، به عنوان مثال در بین صفحات یک خاذن باردار، انرژی الکتریکی وجود دارد. چگالی انرژی یا انرژی الکتریکی در واحد حجم از رابطه ی زیر به دست می آید:
بطور مشابه چگالی انرژی مغناطیسی مثلاً انرژی مغناطیسی در ناحیه بین قطب های یک آهنربا برابر است با:
امواج الکترومغناطیسی
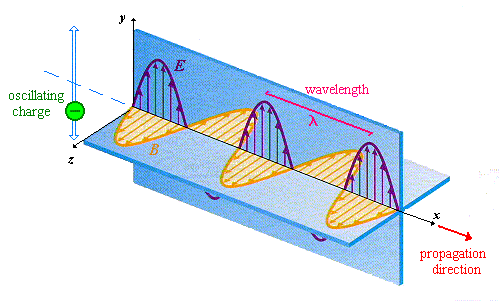
بار الکتریکی ساکن میدان الکتریکی می آفریند. اما بار الکتریکی متحرک علاوه بر میدان الکتریکی، میدان مغناطیسی نیز ایجاد می کند که در قانون آمپر بخوبی نشان داده شده است. بنابراین در اطراف یک بار الکتریکی متحرک دو میدان الکتریکی و مغناطیسی وجود دارد. یعنی با تغییر میدان الکتریکی، میدان مغناطیسی تولید می شود. همچنین میدان مغناطیسی متغییر نیز نیز به نوبه خود، یک میدان الکتریکی می آفریند که با قانون فاراده نشان داده می شود. این مطالب نشان می دهد که چگونه امواج الکترومغناطیسی تولید می شوند. بنابراین یک بار الکتریکی در حال نوسان (شتابدار) در فضا امواج الکتریکی و مغناطیسی تولید می کند. فرکانس این امواج برابر است با فرکانس بار الکتریکی تولید کننده ی امواج. این میدانها، یک میدان الکترومغناطیسی تشکیل می دهند که پس از انتشار با سرعت نور c در فضا منتشر می شود.
امواج الکترومغناطیسی که در بالا توصیف شد بطور نظری در سال 1864 توسط معادلات کلارک ماکسول پیشگویی شد. علاوه بر آن ماکسول نشان داد که سرعت انتشار این امواج در خلاء از رابطه ی زیر به دست می آید:
شدت موج الکترومغناطیسی
شدت موج الکترومغناطیسی برابر است با مقدار انرژی که از واحد سطح در واحد زمان می گذرد که از روابط زیر به دست می آید:
امواج الکترومغناطیسی برای اولین بار توسط هانریش هرتز در سال 1887 در آزمایشگاه مشاهده شد. طیبف امواج الکترومغناطیسی از امواج رادیویی با طول موجهای بلند تا امواج کوتاه گاما را شامل می شود و نور معمولی بخش بسیار ناچیزی از آن را تشکیل می دهد.
کشف اثر فوتوالکتریک
هرتز در جریان آزمایشهایی که برای تایید پیشگویی های نظری ماکسول در مورد امواج الکترومغناطیسی انجام می داد، اثر فوتوالکتریک را نیز کشف کرد. بدین معنی که هرگاه نور بر فلزات بتابد، سبب صدور الکترون از سطح فلز می شود. وقتی که فیزیکدانان به تکرار این آزمایش پرداختند، با کمال تعجب متوجه شدند که شدت نور، تاثیری بر انرژی الکترونهای صادر شده ندارد. اما تغییر طول طول موج نور بر انرژی الکترونها موثر است، مثلاً سرعتی که الکترونها بر اثر نور آبی به دست می آورند، بیشتر از سرعتی است که بر اثر تابش نور زرد به دست می آورند همچنین تعداد الکترونهایی که در نور آبی با شدت کمتر از سطح فلز جدا می شوند، کمتر از تعداد الکترونهایی است که بر اثر نور زرد شدید صادر می شوند. اما باز هم سرعت الکترونهایی که بر اثر نور آبی صادر می شوند، بیشتر از سرعت الکترونهایی است که توسط نور زرد صادر می شوند. علاوه بر آن نور قرمز، هر قدر هم که شدید باشد، نمی تواند از سطح بعضی از فلزات الکترون جدا کند. |
|
|---|
|
نارسایی الکترومغناطیس کلاسیک در توجیه اثر فوتوالکتریک
می دانیم الکترونهای ظرفیت در داخل فلز آزادی حرکت دارند، اما به فلز مقید هستند. برای جدا کردن آنها از سطح فلز بایستی انرژی به اندازه ای باشد که بتواند بر این انرژی مقید فائق آید. در صورتیکه این انرژی کمتر از مقدار لازم باشد، نمی تواند الکترون را از سطح فلز جدا کند. طبق نظریه ی الکترومغناطیس کلاسیک، انرژی الکترومغناطیسی یک کمیت پیوسته بود، لذا هر تابشی می بایست در الکترون ذخیره و با انرژی قدیمی که الکترون داشت، حمع می شد تا زمانیکه انرژی مورد نیاز تامین گردد و الکترون از فلز جدا شود. از طرف دیگر چون مقدار انرژی مقید الکترونهای داخل فلز هم ارز هستند، اگرانرژی لازم برای جدا شدن آنها به اندازه ی کافی می رسید، می بایست با جدا شدن یک الکترون از سطح فلز، تعداد زیادی الکترون آزاد شود. همچنین با توجه به اینکه انرژی پیوسته است، می بایست انرژی تابشی بین الکترونهای آزاد توزیع می شد تا هنگامیکه انرژی همه ی الکترونها به میزان لازم نمی رسید، نمی بایست انتظار جدا شدن الکترونی را داشته باشیم. به عبارت دیگر نمی بایست به محض تابش، شاهد جدا شدن الکترون از سطح فلز بود.
مکانیک کوانتومی
همزمان با این مشکلات که مکانیک کلاسیک با آن رو به رو بود، یک رویداد دیگر در شرف تکوین بود. در سال 1893 ویلهلم وین نظریه ای در باره ی توزیع انرژی تابش جسم سیاه یعنی مقدار انرژی که در یک طول موج معین تابش می کند وضع کرد. بر طبق این نظریه فورمولی به دست آمد که توزیع انرژی را در انتهای بنفش با دقت توصیف می کرد، اما در باره ی توزیع انرژی در انتهای قرمز طیف صدق نمی کرد. از طرف دیگر لرد ریلی و جیمز جینز معادله ای به دست آوردند که توزیع انرژی را در انتهای قرمز طیف بیان می کرد ولی در انتهای بنفش صدق نمی کرد. ماکس پلانک در باره ی این مسئله به پژهش پرداخت و متوجه شد که به جای منطبق ساختن معادلات با واقعیات، باید مفهوم کاملاً جدیدی مطرح کند. به این ترتیب اولین قدم را ماکس پلانک در سال 1900 با معرفی مفهوم کوانتوم یا گسستگی انرژی برداشت. وی تنها زمانی توانست پدیده تابش جسم سیاه را توصیف کند که فرض کرد مبادله انرژی بین تابش و محیط با مقدارهای گسسته یا کوانتیزه انجام می شود. این نظر پلانک باعث کشف های جدیدی شد که نتیجه آن ارائه راه حل هایی برای برجسته ترین مسئله های آن زمان بود. وی اعلام کرد انرژی E کمیتی گسسته است که آن را کوانتوم انرژی نامید و هر کوانتوم انرژی ضریبی از یک پایه انرژی است که در رابطه ی زیر صدق می کند:
E = nhf
n عدد صحیح h ثابت پلانک است.
توجیه کوانتومی پدیده فوتوالکتریک توسط انیشتین
انیشتین در سال 1905 با استفاده از نظریه کوانتومی انرژی پدیده فوتوالکتریک را توضیح داد. بنابر نظریه ی کوانتومی امواج الکترومغناطیسی که به ظاهر پیوسته اند، کوانتومی می باشند. این کوانتومهای انرژی را که فوتون می نامند، از رابطه ی پلانک تبعیت می کنند. بنابر نظریه کوانتومی، یک باریکه ی نور با فرکانس f شامل تعدادی فوتونهای ذره گونه است که هر یک دارای انرژی E=hf می باشد. یک فوتون تنها می تواند با یک الکترون در سطح فلز برهم کنش کند، این فوتون نمی تواند انرژی خود را بین چندین الکترون تقسیم کند. چون فوتونها با سرعت نور حرکت می کنند، بر اساس نظریه نسبیت، باید دارای جرم حالت سکون صفر باشند و تمام انرژی آنها جنبشی است. هنگامیکه ذره ای با جرم حالت سکون صفر از حرکت باز می ماند، موجودیت آن از بین می رود و تنها زمانی وجود دارد که با سرعت نور حرکت کند. از این رو وقتی فوتونی با یک الکترون مقید در سطح فلز برخورد می کند و پس از آن دیگر با سرعت منحصر بفرد نور c حرکت نمی کند، تمام انرژی hf خود را به الکترونی که با آن برخورد کرده است می دهد. اگر انرژیی که الکترون مقید از فوتون به دست می آورد از انرژی بستگی به سطح فلز بیشتر باشد، زیادی انرژی به صورت انرژی جنبشی فوتوالکترون در می آید. اگر فرض کنیم انرژی بستگی الکترون بر سطح فلز w باشد که این مقدار برابر باشد با انرژی w=hf0 آنگاه یک فوتون با انرژی hf زمانی می تواند الکترون را از سطح فلز جدا کند که:
hf>w=hf0
چنانچه انرژی فوتون فرودی بیشتر از انرژی بستگی الکترون باشد، مابقی انرژی بصورت انرژی جنبشی الکترون ظاهر می شود. و خواهیم داشت:
hf=1/2 m0 v2 +hf0
بهمین دلیل اگر انرژی نور تابشی کمتر از انرژی بستگی فوتون باشد، با هر شدتی که بر سطح فلز بتابد، پدیده فوتوالکتریک روی نمی دهد. علاوه بر آن به محض رسیدن فوتون با انرژی کافی بر سطح فلز، گسیل فوتوالکتریک بی درنگ اتفاق می افتد. هرچند در اینجا بحث در مورد اثر تابش بر سطح فلز بود، اما این اثر به فلزات محدود نمی شود. بطور کلی هرگاه فوتونی با انرژی کافی به الکترون مقید برخورد کند، الکترون را از اتم جدا می کند و اتم یونیزه می شود. همچنین شدت موج الکترومغناطیسی در نظریه مکانیک کوانتوم مفهوم جدیدی پیدا کرد. در مکانیک کوانتوم شدت موج تکفام الکترومغناطیسی برابر است با حاصلضرب انرژی هر فوتون در تعداد فوتونهایی که در واحد زمان از واحد سطح عبور می کنند.
|
|
|---|
|
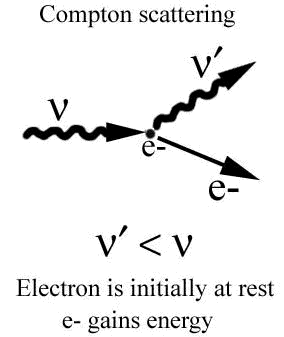
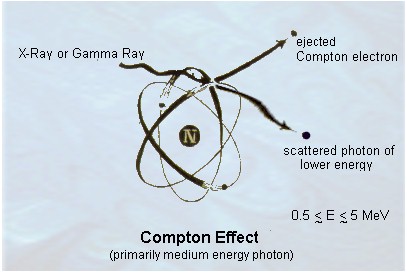
اثر کامپتون
در اثر فوتوالکتریک، فوتون همه ی انرژی خود را به الکترون می دهد، اما ممکن است در برخورد فوتون با ذره ی باردار، فوتون تنها قسمتی از انرژی خود را از دست بدهد. این نوع برهم کنش بین امواج الکترومغناطیسی و اجسام، همان پراکندگی امواج الکترومغناطیسی توسط ذرات باردار جسم است. نظریه کوانتومی پراکندگی امواج الکترومغناطیسی، به اثر کامپتون مشهور است. کامپتون در سال 1922 با استفاده از تعبیر موفق انیشتین در مورد اثر فوتوالکتریک، مفهوم ذره گونه ی فوتون یعنی طبیعت کوانتومی تابش الکترومغناطیسی را برای توضیح پراکندگی پرتوهای x به کار برد. در نظریه کوانتومی یک فوتون با نرژی:
E=hf=mc2 و جرم حالت سکون صفر، که با سرعت c در حرکت است، دارای اندازه حرکت خطی p می باشد. با در نظر گرفتن اینکه اندازه حرکت یک فوتون باید برابر جرم نسبیتی در سرعت فوتون باشد، می توان نوشت:
p=mc=hf/c=h/l که در آن l طول موج است. وقتی یک باریکه ی الکترومغناطیسی تکفام را به عنوان مجموعه ای متشکل از فوتونهای ذره گونه که هریک دارای انرژی و اندازه ی حرکت دقیقاً معلوم در نظر بگیریم، عملاً پراکندگی تابش الکترومغناطیسی به صورت مسئله ای که شامل برخورد فوتون با یک ذره ی باردار است در می آید. نظریه کوانتومی ایجاب می کند که ذره ی باردار در هنگام برخورد با فوتون، انرژی کسب کند. در اینجا فوتون قسمتی از انرژی خود را از دست می دهد و این انرژی به ذره ی باردار منتقل می شود. در این صورت ذره و فوتون هر دو با انرژی و اندازه ی حرکت جدید در مسیرهایی که الزاماً مسیر قبلی نیست به حرکت خود ادامه می دهند.
بررسی برخورد کامپتون بین یک فوتون و یک الکترون را می توان در حالت کلی، حتی زمانی که الکترون مقید است، در نظر گرفت.
نتیجه گیری با دقت به اثر فوتوالکتریک و اثر کامپتون بخوبی مشاهده می شود که یک - یک فوتون تمام انرژی خود را به الکترون منتقل می کند دو - یک الکترون ممکن است قسمتی از انرژی خود را به الکترون منقل کند سه - در نسبیت فرض می شود که فوتون دارای جرم حالت سکون صفر است در ادامه این موارد را مجدداً مورد بررسی قرار می دهیم
اثر موسبوئر بياييد يكي از پيشگويي هاي نسبيت اينشتين را مورد توجه قرار دهيم. طبيق پيشگويي نسبيت هرگاه نور در ميدان گرانشي سقوط كند، فركانس و در نتيجه انرژي آن افزايش مي يابد كه آن را جابجايي به سمت آبي مي گويند. عكس اين حالت نيز صادق است، يعني هنگاميكه نور در حال ترك (فرار) از يك ميدان گرانشي است، فركانس و در نتيجه انرژي آن كاهش مي يابد كه مي گويند جابجايي به سمت سرخ گرانش است. اين پيشگويي براي مدتها قابل آزمايش نبود تا آنكه موسبوئر در سال 1958 نشان داد كه يك بلور در بعضي شرايط مي تواند دسته اشعه ي گاما با طول موج كاملاَ معيني توليد كند. اشعه ي گاما با چنين طول موجي را مي توان با بلوري مشابه بلوري كه آن را توليد كرده است جذب كرد. اگر طول موج اشعه ي گاما فقط مختصري با طول موج اشعه اي كه توسط بلور توليد مي شود تفاوت داشته باشد، به وسيله آن جذب نخواهد شد. اين پديده را اثر موسبوئر مي نامند. آزمايشهايي كه |
|---|
سلامی دوباره به دانشجویان عزیز:
هنگامی که در حال ارسال گزارس کارهای خود هستتید متنتان را با اندازه ی 12 و به رنگ مشکی ارسال کنید
با تشکر
شکیبازاده
















 آمار
وب سایت:
آمار
وب سایت:

